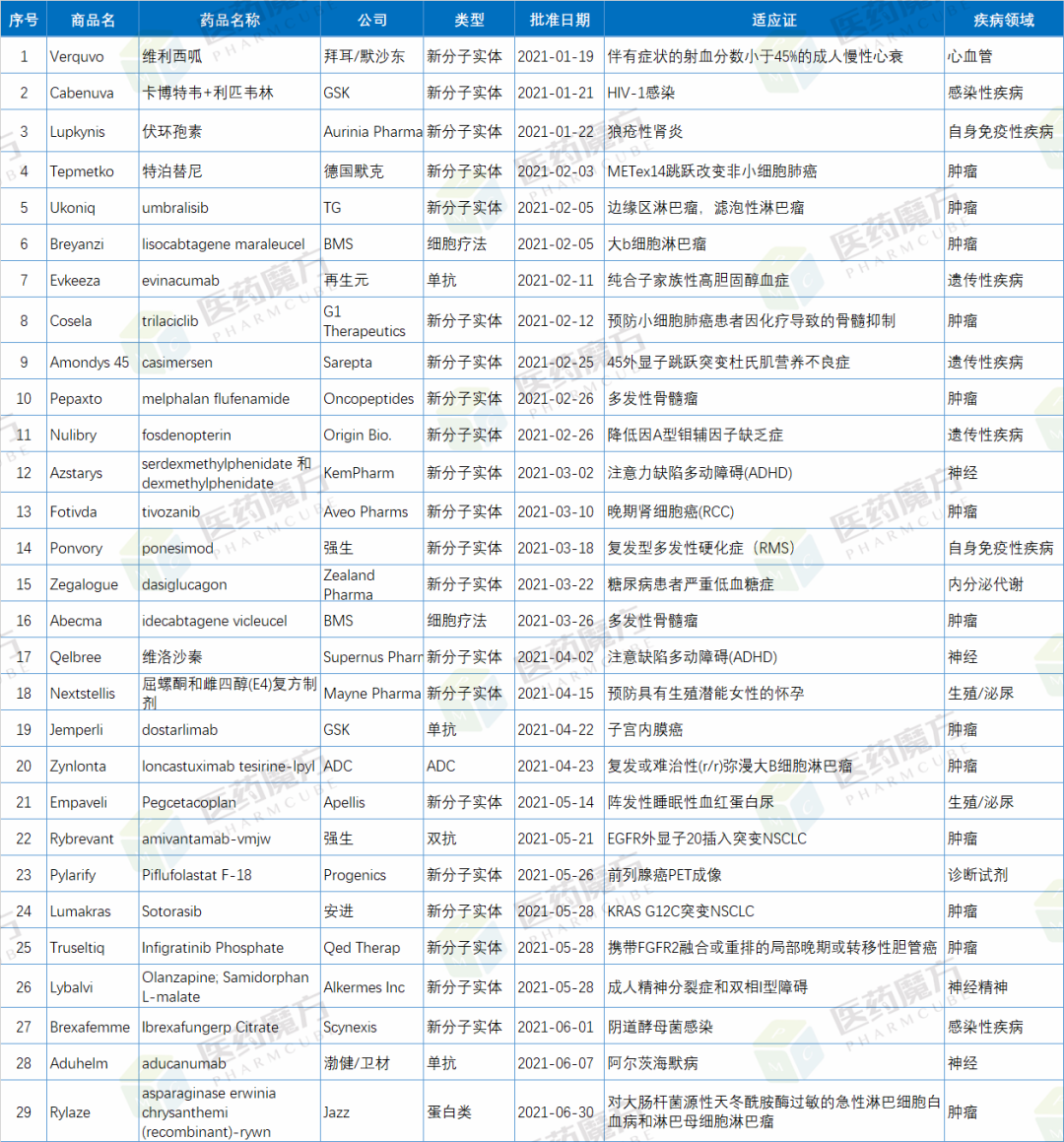
2021年上半年,F(xiàn)DA共批準(zhǔn)27款新藥,其中包括21款新分子實(shí)體藥物,6款生物制品。另外,F(xiàn)DA還批準(zhǔn)了2款細(xì)胞療法。

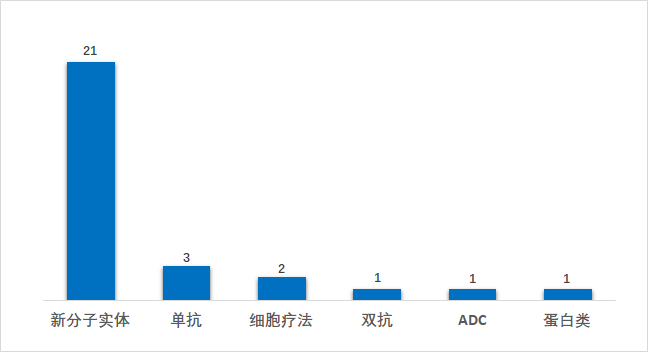
從疾病領(lǐng)域來(lái)看,2021年上半年FDA批準(zhǔn)的新藥仍以腫瘤藥居多,占比45%(13/29),神經(jīng)精神(14%,4/29)、遺傳性疾病(10%,3/29)、生殖泌尿系統(tǒng)疾病7%(2/29)、感染性疾病7%(2/29)等領(lǐng)域也分別有新藥獲批。
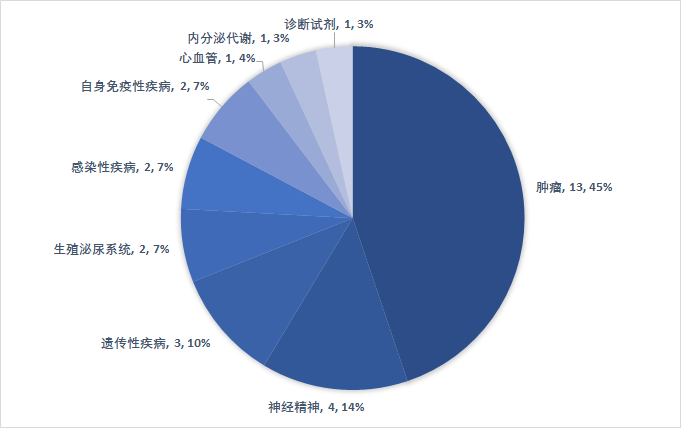
從審評(píng)方式上看,上半年共有20個(gè)(69%)新藥是以“優(yōu)先審評(píng)”的方式獲得FDA批準(zhǔn)上市,包括14款新分子實(shí)體、和6款生物藥。有11個(gè)品種被FDA授予“孤兒藥”資格,占比38%。
上半年獲批的新藥中,有9款屬于First-in-class療法,具體品種如下:
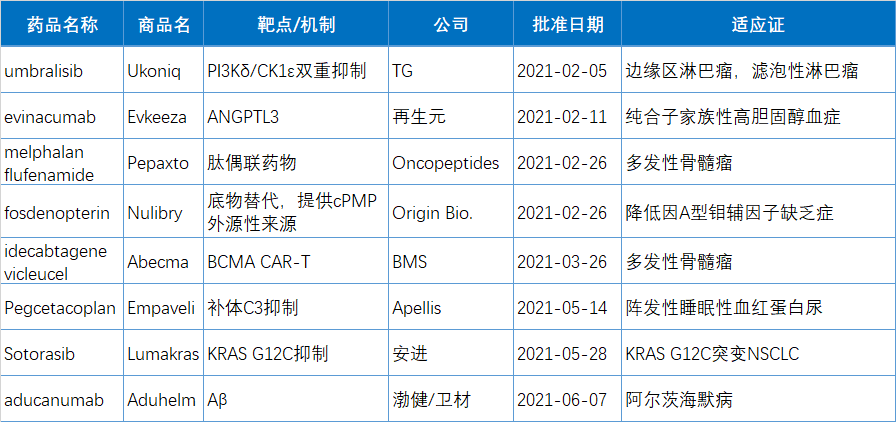
上半年有10款新藥(34.5%)被FDA授予突破性療法(BTD)資格,包括5個(gè)生物制品,占上半年獲批生物制品的63%。另有5個(gè)獲得BTD資格的是小分子藥物,占到今年獲批小分子藥物的24%。
以下為10款突破性療法簡(jiǎn)單介紹:
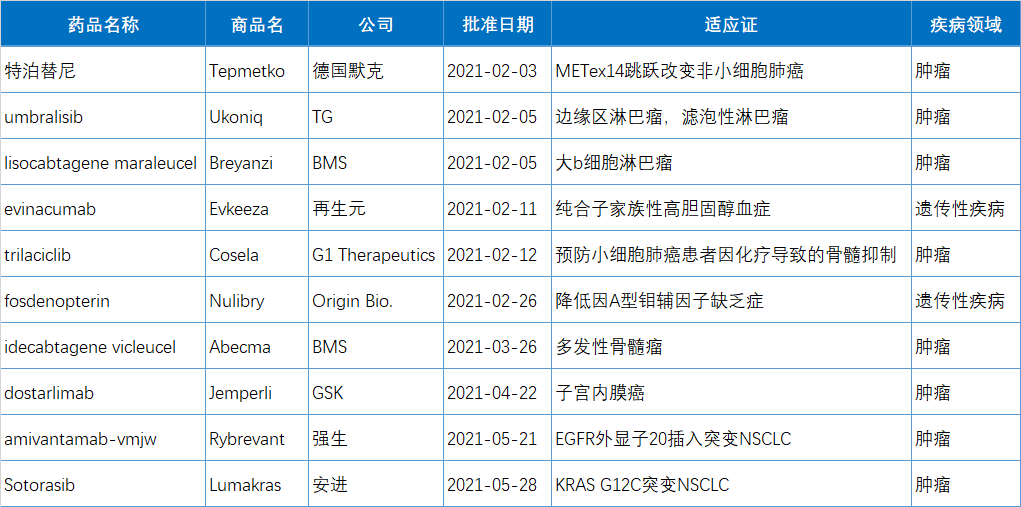
特泊替尼(tepotinib)
適應(yīng)癥:治療攜帶MET基因第14號(hào)外顯子(MET ex14)跳躍突變的轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)成人患者,這類侵襲性肺癌患者通常是老年人,預(yù)后較差。目前臨床迫切需要能夠產(chǎn)生持久抗腫瘤活性的靶向療法以改善這種挑戰(zhàn)性疾病患者的生活。
2月3日,德國(guó)默克(Merck KGaA)旗下EMD Serono宣布,F(xiàn)DA已加速批準(zhǔn)口服MET抑制劑特泊替尼(tepotinib,EMD 1214063,Tepmetko)上市,用于治療攜帶MET外顯子14(METex14)跳躍變異的轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)成人患者。
特泊替尼(tepotinib)是全球上市的第一款MET抑制劑(于2020年3月由日本厚生勞動(dòng)省首先批準(zhǔn)上市),F(xiàn)DA批準(zhǔn)的第二款MET抑制(第一款為卡馬替尼);同時(shí)是FAD批準(zhǔn)的第63個(gè)小分子激酶抑制劑,也是FDA在2021年批準(zhǔn)的第1個(gè)小分子激酶抑制劑。
這一批準(zhǔn)基于一項(xiàng)有152名攜帶METex14跳躍變異的晚期或轉(zhuǎn)移性NSCLC患者參與VISION 2期臨床試驗(yàn),驗(yàn)結(jié)果顯示:替波替尼(tepotinib)在初治和經(jīng)治患者中的總緩解率均達(dá)到43%。初治和經(jīng)治患者的中位緩解持續(xù)時(shí)間(DOR)分別為10.8個(gè)月(95% CI,6.9-NE)和11.1個(gè)月(95% CI,9.5-18.5)。67%的初治患者和75%的經(jīng)治患者的緩解持續(xù)時(shí)間為6個(gè)月以上,30%的初治患者和50%的經(jīng)治患者的緩解持續(xù)時(shí)間為9個(gè)月以上。
特泊替尼(tepotinib)是默克內(nèi)部發(fā)現(xiàn)的一種口服MET激酶抑制劑,可強(qiáng)效、高度選擇性抑制由MET(基因)改變——包括MET第14號(hào)外顯子跳躍突變、MET擴(kuò)增或MET蛋白過(guò)表達(dá)引起的致癌信號(hào),具有改善攜帶這些特定MET改變的侵襲性腫瘤患者治療預(yù)后的潛力。除了NSCLC之外,默克也正在積極評(píng)估特泊替尼(tepotinib)聯(lián)合新療法治療其他腫瘤適應(yīng)癥。
umbralisib
適應(yīng)癥:用于治療之前至少接受過(guò)一種基于抗CD20治療方案的復(fù)發(fā)或難治性邊緣區(qū)淋巴瘤(MZL)成人患者和之前至少接受過(guò)三線全身治療的復(fù)發(fā)或難治性濾泡性淋巴瘤(FL)成人患者。
Umbralisib由TG公司開(kāi)發(fā),是首個(gè)也是唯一一個(gè)獲批上市的每日口服1次的磷酸肌醇3激酶(PI3K ) δ和酪蛋白激酶1 (CK1) ε抑制劑。PI3K-δ在支持細(xì)胞增殖和生存、細(xì)胞分化、細(xì)胞間運(yùn)輸和免疫方面發(fā)揮重要作用,在正常和惡性b細(xì)胞中都有表達(dá)。CK1-ε是一種癌蛋白翻譯調(diào)節(jié)因子,與癌細(xì)胞包括淋巴惡性腫瘤發(fā)病機(jī)制有關(guān)。此前,umbralisib治療MZL適應(yīng)癥曾獲FDA突破性療法認(rèn)定,上市申請(qǐng)也被納入優(yōu)先審評(píng)。umbralisib也被授予治療MZL和FL的孤兒藥認(rèn)定 (ODD)。
umbralisib分子結(jié)構(gòu)式
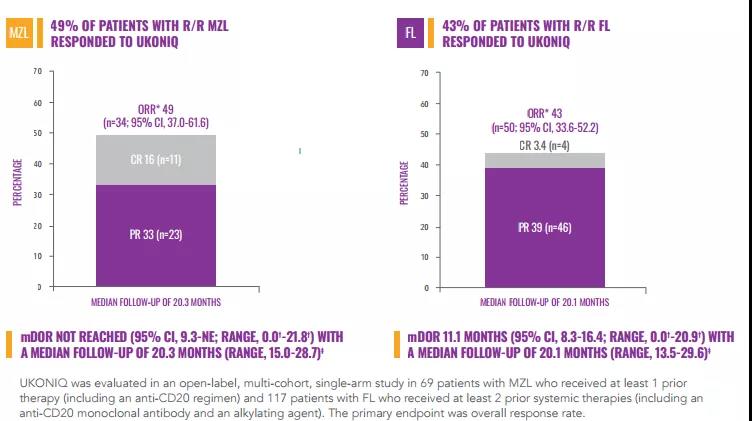
MZL和FL適應(yīng)癥的加速獲批是基于一項(xiàng)II期UNITY-NHL (NCT02793583)研究的總緩解率(ORR)數(shù)據(jù)。UNITY-NHL研究是一項(xiàng)開(kāi)放標(biāo)簽,多中心,雙隊(duì)列研究,2個(gè)隊(duì)列分別招募了69例 MZL患者和117 例FL患者,受試者接受每日口服1次umbralisib(800mg)治療,直至疾病進(jìn)展或不可耐受毒性。研究結(jié)果表明,MZL患者的總緩解率(ORR)為49% ,完全緩解率(CR)為16%,中位緩解持續(xù)時(shí)間(DOR)尚未達(dá)到。FL患者ORR為43%,CR為3.4%,DOR為11.1個(gè)月。
lisocabtagene maraleucel
適應(yīng)癥:治療成人復(fù)發(fā)或難治性大b細(xì)胞淋巴瘤。
2021年2月5日,F(xiàn)DA批準(zhǔn)了lisocabtagene maraleucel用于經(jīng)≥2線全身治療的復(fù)發(fā)/難治性(R/R)大B細(xì)胞淋巴瘤成人患者,包括彌漫性大B細(xì)胞淋巴瘤(DLBCL)、高級(jí)別B細(xì)胞淋巴瘤、原發(fā)性縱隔大B細(xì)胞淋巴瘤和3B級(jí)濾泡性淋巴瘤患者。
在192例可評(píng)估療效的患者中,根據(jù)獨(dú)立審查委員會(huì)(IRC)評(píng)估的總體緩解率(ORR)為73%(95%CI:67-80),完全緩解(CR)率為54%(95%CI:47-61)。至第一次緩解的中位時(shí)間為1個(gè)月。在104例達(dá)到CR的患者中,有65%的患者緩解持續(xù)了至少6個(gè)月,62%的患者緩解持續(xù)了至少9個(gè)月。CR患者的估計(jì)中位緩解持續(xù)時(shí)間(DOR)未達(dá)到(95%CI:16.7-NR),部分緩解(PR)患者的估計(jì)中位DOR為1.4個(gè)月(95%CI:1.1-2.2)。
evinacumab
適應(yīng)癥:作為其他降脂藥物的輔助療法用于治療成人和12歲以上兒科純合子家族性高膽固醇血癥(HoFH)。
Evinacumab是一種靶向血管生成素樣蛋白3 (ANGPTL3) 的全人源IgG4κ型單抗,是一種全新機(jī)制的降脂藥,通過(guò)抑制ANGPTL3而間接加速體內(nèi)脂肪的降解。此前已獲得FDA授予的孤兒藥資格,優(yōu)先審評(píng)資格和突破性療法認(rèn)定,是第一個(gè)上市的ANGPTL3抑制劑。
HoFH是一種罕見(jiàn)的家族遺傳性脂質(zhì)代謝異常疾病,病因是控制人體清除膽固醇的PCSK9,LDLR或APOB基因在復(fù)制時(shí)產(chǎn)生突變,導(dǎo)致膽固醇無(wú)法正常代謝。患者通常伴隨著極高的低密度脂蛋白 (LDL-C)水平,通常在青少年期就發(fā)展為嚴(yán)重的心血管疾病,且治療方案有限,常規(guī)的PCSK9抑制劑和其他降脂療法(如他汀類藥物)對(duì)其都沒(méi)有顯著療效,此次evinacumab的獲批,可謂是HoFH患者期盼已久的福音。
trilaciclib
適應(yīng)癥:預(yù)防擴(kuò)散期小細(xì)胞肺癌成人患者因鉑類╱依托泊苷方案或拓?fù)涮婵捣桨富瘜W(xué)治療導(dǎo)致的骨髓抑制。
G1 Therapeutics于今年2月底對(duì)外宣布,F(xiàn)DA已批準(zhǔn)Cosela(trilaciclib)注射液,用于廣泛期非小細(xì)胞肺癌(ES-SCLC)成人患者,在接受含鉑/依托泊苷的化療方案或含拓?fù)涮婵档幕煼桨钢敖o藥,以降低化療誘導(dǎo)的骨髓抑制的發(fā)生率。Cosela通過(guò)優(yōu)先審查程序獲得批準(zhǔn),之前已被美國(guó)FDA授予突破性藥物資格(BTD)。
值得一提的是,Cosela是全球第一款也是唯一一款可降低化療誘導(dǎo)的骨髓抑制發(fā)生率的骨髓保護(hù)療法,能夠?yàn)榻邮芑煹腅S-SCLC患者骨髓起到保護(hù)作用。Cosela的骨髓保護(hù)作用,可降低嚴(yán)重中性粒細(xì)胞減少癥和貧血的發(fā)生率和持續(xù)時(shí)間、減少諸如生長(zhǎng)因子和紅細(xì)胞輸注等搶救性干預(yù)措施的需要。紅細(xì)胞輸注等搶救性干預(yù)措施的需要。
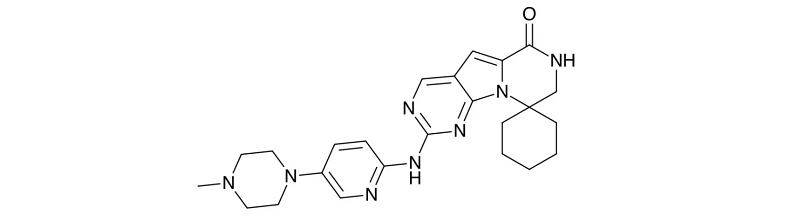
fosdenopterin
適應(yīng)癥:用于降低因A型鉬輔因子缺乏(MoCD)導(dǎo)致的死亡風(fēng)險(xiǎn)。
Nulibry(fosdenopterin)由BridgeBio子公司Origin Biosciences開(kāi)發(fā),是FDA批準(zhǔn)的首款治療該疾病創(chuàng)新療法。A型鉬輔因子缺乏癥是一種罕見(jiàn)的、遺傳代謝性疾病,通常發(fā)病于出生幾日的嬰兒,會(huì)導(dǎo)致頑固性癲癇發(fā)作、腦損傷和死亡。全球共不到150例患者受此疾病影響,患者中位生存時(shí)間為4年。
Fosdenopterin是一種底物替代療法,提供了cPMP(環(huán)吡喃單磷酸)的外源性來(lái)源,cPMP可轉(zhuǎn)化為鉬嘌呤,而鉬嘌呤又可轉(zhuǎn)化為鉬輔因子,以防止因鉬輔因子缺乏而導(dǎo)致的亞硫酸鹽氧化酶合成減少進(jìn)而導(dǎo)致的毒亞硫酸鹽的積累,從而緩解嬰幼兒A 型MoCD 的中樞神經(jīng)系統(tǒng)癥狀。Nulibry曾獲得FDA授予的優(yōu)先審評(píng)資格、突破性療法認(rèn)定和孤兒藥資格認(rèn)定。
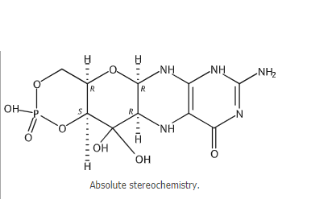
idecabtagene vicleucel
適應(yīng)癥:用于治療復(fù)發(fā)或難治性多發(fā)性骨髓瘤成人患者,這些患者既往經(jīng)過(guò)四線及以上包括免疫調(diào)節(jié)劑、蛋白酶體抑制劑和抗CD38單克隆抗體的治療。
2021年3月26日,F(xiàn)DA批準(zhǔn)idecabtagene vicleucel治療既往接受≥4線療法(包括免疫調(diào)節(jié)劑、蛋白酶體抑制劑和抗CD38單克隆抗體)的復(fù)發(fā)/難治性多發(fā)性骨髓瘤成人患者。這是FDA批準(zhǔn)的首個(gè)針對(duì)多發(fā)性骨髓瘤的基于細(xì)胞的基因療法。
Idecabtagene vicleucel是靶向B細(xì)胞成熟抗原(BCMA)的基因修飾自體嵌合抗原受體(CAR)T細(xì)胞療法,是使用患者自己的T細(xì)胞進(jìn)行定制的,這些T細(xì)胞會(huì)被收集并進(jìn)行基因修飾,然后再注入患者體內(nèi)。
一項(xiàng)多中心研究對(duì)127例復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者(既往接受≥3線抗骨髓瘤治療,其中88%的患者既往接受了≥4線治療)評(píng)估了安全性和療效。接受idecabtagene vicleucel(劑量為300-460x106CAR陽(yáng)性T細(xì)胞)的100例患者進(jìn)行了療效評(píng)估。主要療效指標(biāo)為獨(dú)立評(píng)審委員會(huì)評(píng)估的總體緩解率(ORR)、完全緩解(CR)率和緩解持續(xù)時(shí)間(DOR)。
結(jié)果顯示,ORR為72%(95%CI:62%,81%),CR率為28%(95%CI:19%,38%)。據(jù)估計(jì),達(dá)到CR患者中有65%的患者的CR狀態(tài)持續(xù)了12個(gè)月。
dostarlimab
適應(yīng)癥:治療此前接受含鉑化療后疾病進(jìn)展,且存在DNA錯(cuò)配修復(fù)缺陷(dMMR)的成人復(fù)發(fā)性或晚期子宮內(nèi)膜癌患者。
FDA于4月22日加速批準(zhǔn)GSK抗PD-1抗體Jemperli (dostarlimab)上市,是FDA獲批上市的第7款PD-1,F(xiàn)DA曾授予dostarlimab治療復(fù)發(fā)或晚期dMMR子宮內(nèi)膜癌突破性療法認(rèn)定。
Dostarlimab是一款程序性死亡受體-1 (PD-1)阻斷抗體,能夠與PD-1受體結(jié)合,從而阻斷其與PD-L1和PD-L2配體結(jié)合,抑制腫瘤免疫逃逸。dostarlimab最初由AnaptysBio公司發(fā)現(xiàn),2014年3月TESARO獲得了在全球開(kāi)發(fā)和商業(yè)化dostarlimab的權(quán)利,2018年12月GSK收購(gòu)TESARO,將dostarlimab收入囊中。
FDA此次加速批準(zhǔn)是基于一項(xiàng)正在進(jìn)行的大型、多中心、非隨機(jī)、多隊(duì)列、開(kāi)放標(biāo)簽GARNET研究中dMMR子宮內(nèi)膜癌隊(duì)列研究結(jié)果。研究結(jié)果顯示,71例此前接受過(guò)含鉑化療后疾病進(jìn)展且存在dMMR復(fù)發(fā)或晚期子宮內(nèi)膜癌患者的ORR(客觀緩解率)為42.3% (95% CI; 30.6-54.6),包括12.7% 的CR(完全緩解)和29.6%的PR(部分緩解)。這些產(chǎn)生緩解的患者中,有93.3%患者達(dá)到6個(gè)月或以上的DOR(緩解持續(xù)時(shí)間)。
amivantamab-vmjw
適應(yīng)癥:治療鉑類化療后進(jìn)展的EGFR外顯子20插入突變的轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者。
5月21日,amivantamab-vmjw被FDA批準(zhǔn)用于治療腫瘤細(xì)胞中攜帶EGFR外顯子20插入突變的NSCLC,成為首款獲批用于此類適應(yīng)癥的藥物,同時(shí)Guardant360 CDx檢測(cè)也被批準(zhǔn)用作該適應(yīng)癥的伴隨診斷。
“精準(zhǔn)腫瘤學(xué)的進(jìn)步促進(jìn)了藥物的開(kāi)發(fā),使得包括肺癌在內(nèi)的多種癌癥可以根據(jù)生物標(biāo)志物被細(xì)分,為患者提供精準(zhǔn)治療”,F(xiàn)DA腫瘤卓越中心腫瘤學(xué)主任兼FDA藥物評(píng)價(jià)和研究中心副主任Julia Beaver博士在一次新聞發(fā)布會(huì)上表示。“此前,攜帶EGFR外顯子20插入突變的NSCLC并沒(méi)有標(biāo)準(zhǔn)靶向療法,而此次amivantamab-vmjw獲批后,該適應(yīng)癥患者首次有了合適的靶向治療方案。”
這項(xiàng)1期CHRYSALIS試驗(yàn)(NCT02609776)的數(shù)據(jù)已于2020年世界肺癌大會(huì)上展示,在EGFR外顯子20插入突變的NSCLC患者(n =81)中,amivantamab-vmjw在40%的患者中誘導(dǎo)了客觀緩解,其中47%患者的緩解持續(xù)時(shí)間至少為6個(gè)月,47%的患者在中位隨訪9個(gè)月后仍在接受治療。
總共有3例完全緩解和29例部分緩解,中位緩解持續(xù)時(shí)間為11.1個(gè)月。疾病控制率為48%(n=39),臨床獲益率為74%;8例患者(10%)發(fā)生疾病進(jìn)展。中位無(wú)進(jìn)展生存期為8.3個(gè)月,中位總生存期為22.8個(gè)月。
3級(jí)或以上不良事件(AE)的發(fā)生率為16%,嚴(yán)重AE的發(fā)生率為9%;停藥發(fā)生率為4%,劑量減少和治療中斷的發(fā)生率分別為13%和21%。
研究包括劑量遞增隊(duì)列和劑量擴(kuò)展隊(duì)列,其中,對(duì)劑量遞增隊(duì)列中的患者給予2期劑量治療,即體重<80 kg的患者劑量為1050 mg,≥80 kg的患者劑量為1400 mg。該隊(duì)列中患者在接受鉑類化療后出現(xiàn)了疾病進(jìn)展,對(duì)其中114例患者進(jìn)行了安全性分析,對(duì)81例患者進(jìn)行了3次或以上的療效評(píng)估。主要終點(diǎn)為總緩解率。
基線患者人群統(tǒng)計(jì)數(shù)據(jù)表明,大多數(shù)為女性(59%),中位年齡為62歲(范圍:42-84歲)。吸煙者(47%)和非吸煙者(53%)人數(shù)相當(dāng)。所有患者既往都接受過(guò)鉑類藥物雙化療,46%的患者接受過(guò)免疫治療,25%的患者接受過(guò)EGFR酪氨酸激酶抑制劑靶向治療。患者既往治療的中位數(shù)為2(范圍:1-7)。
此前FDA于Orbis項(xiàng)目下授予了amivantamab-vmjw優(yōu)先評(píng)審資格和突破性療法認(rèn)定,Orbis由FDA腫瘤卓越中心倡議,有助于多個(gè)國(guó)際機(jī)構(gòu)同時(shí)提交和審查腫瘤治療藥物。
Amivantamab在中國(guó)也于2020年9月獲得了CDE授予的突破性療法資格。目前國(guó)內(nèi)開(kāi)發(fā)EGFR/c-Met雙抗藥物的公司有岸邁生物、貝達(dá)藥業(yè)、嘉和生物。
Sotorasib
適應(yīng)癥:治療既往至少接受過(guò)一次系統(tǒng)治療的攜帶KRAS G12C突變局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者。
Lumakras(sotorasib,AMG 510)由安進(jìn)開(kāi)發(fā),是全球首個(gè)獲得批準(zhǔn)的靶向KRAS突變的腫瘤治療藥物。
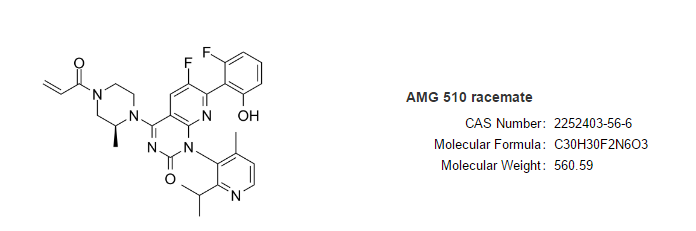
FDA的加速批準(zhǔn)是基于一項(xiàng)代號(hào)為CodeBreaK 100的I/II期臨床研究結(jié)果。在既往接受過(guò)化療和/或免疫療法疾病進(jìn)展KRAS G12C突變的124例NSCLC患者中,sotorasib達(dá)到36%的客觀緩解率(ORR),其中58%的患者持續(xù)緩解≥6個(gè)月。
Sotorasib已于今年1月28 日被CDE納入突破性療法,國(guó)內(nèi)已申報(bào)臨床的KRAS G12C抑制劑的企業(yè)除了安進(jìn)外,還包括貝達(dá)藥業(yè)、北京加科思、益方生物、勁方藥業(yè)、勤浩醫(yī)藥、諾華。