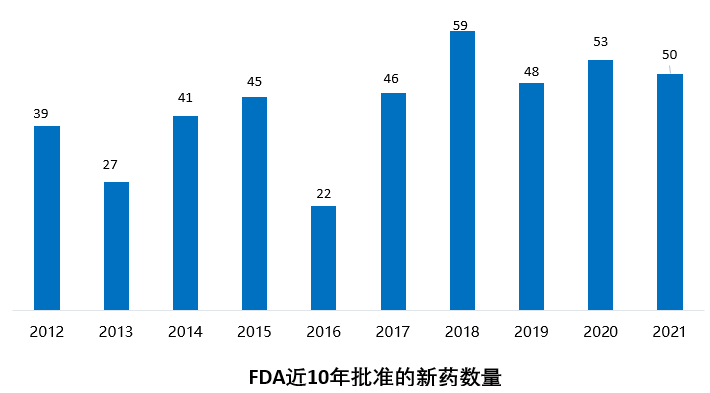
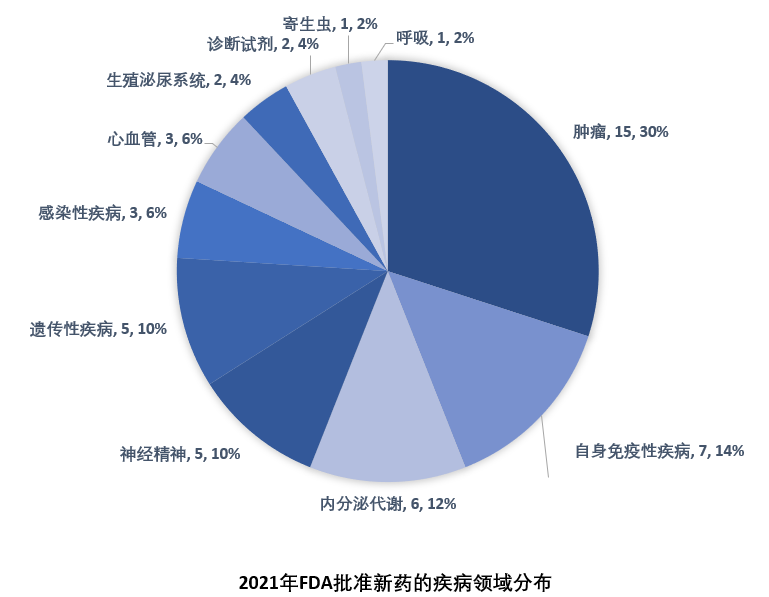
2021年FDA共批準50款新藥(不包括細胞療法和疫苗),較2020年的53款新藥審批略有下降。
相比FDA的略有下降,中國的新藥審批則迎來的井噴。數(shù)據(jù)顯示,2021年國家藥品監(jiān)督管理局共批準83款新藥,其中國產(chǎn)新藥51款,進口新藥32款,創(chuàng)下了自2016年藥品審評審批改革以來的新高。
2021年FDA共批準50款新藥(不包括細胞療法和疫苗),包括36個新分子實體和14個新生物制品。
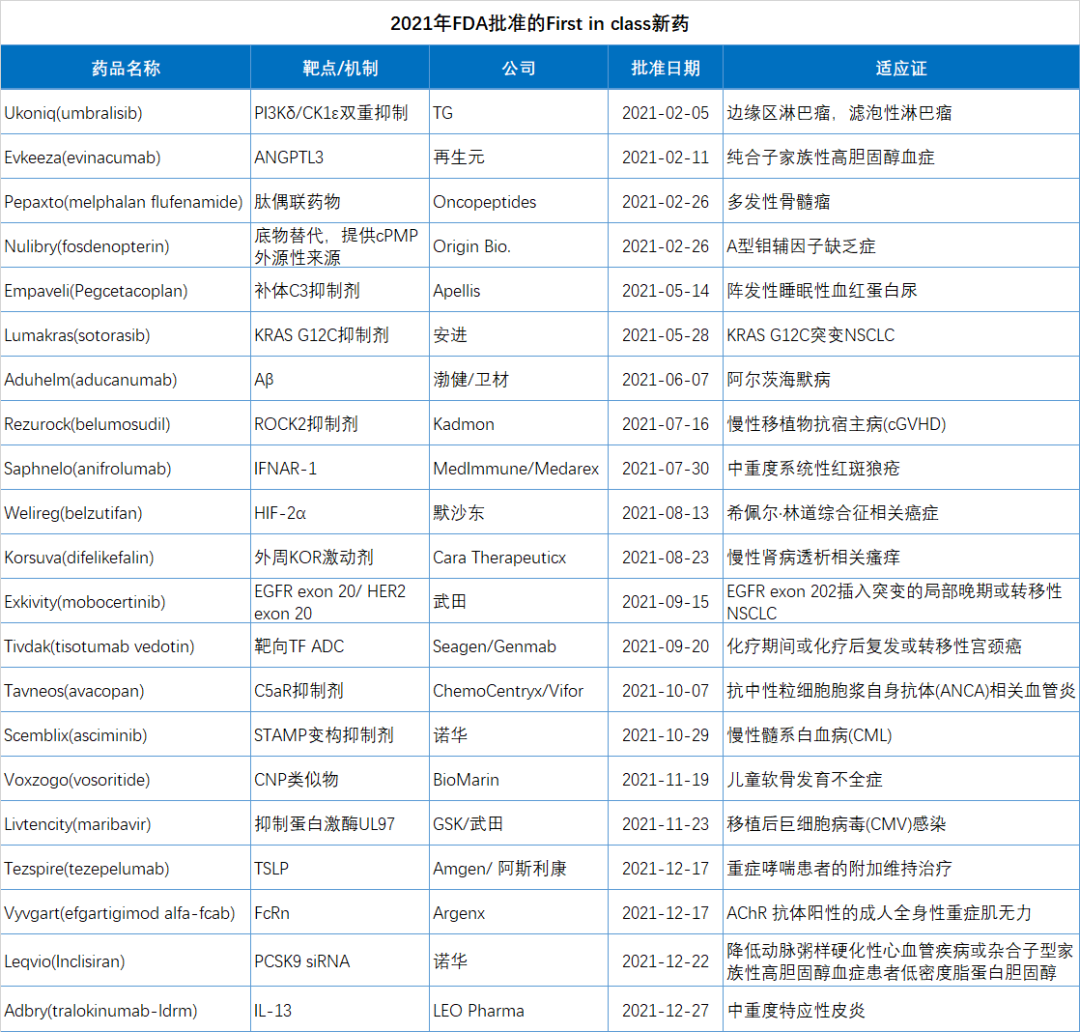

由于篇幅所限,本文精選了2021年批準的15個突破性療法進行簡單介紹。
Tepmetko由德國默克自主研發(fā),可抑制MET基因突變引起的致癌MET受體信號。該產(chǎn)品最早于2020年3月在日本獲批上市,是全球首個獲得監(jiān)管部門批準用于治療MET基因突變晚期NSCLC的口服MET抑制劑,同時也是FDA批準的首個也是唯一一個每日口服1次的MET抑制劑。
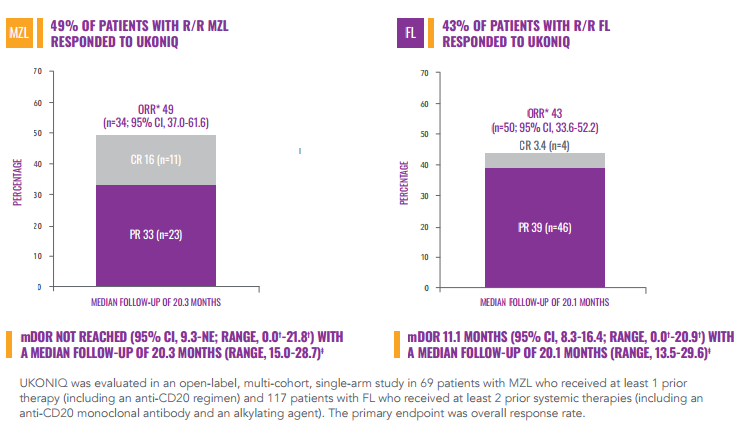
Umbralisib由TG公司開發(fā),是首個也是唯一一個獲批上市的每日口服1次的磷酸肌醇3激酶(PI3K ) δ和酪蛋白激酶1 (CK1) ε抑制劑。
MZL和FL適應癥的加速獲批是基于一項開放標簽,多中心,雙隊列II期UNITY-NHL研究總緩解率(ORR)數(shù)據(jù)。研究結(jié)果表明,MZL患者的總緩解率(ORR)為49% ,完全緩解率(CR)為16%,中位緩解持續(xù)時間(DOR)尚未達到。FL患者ORR為43%,CR為3.4%,DOR為11.1個月。
Evkeeza由再生元開發(fā),是FDA批準的首個靶向血管生成素樣蛋白3(ANGPTL3)的藥物。ANGPTL3是肝臟分泌的一種蛋白,主要在人和小鼠肝臟表達,在脂質(zhì)代謝中發(fā)揮著關(guān)鍵作用,與脂代謝紊亂、冠心病與動脈粥樣硬化、糖尿病、代謝綜合征、腎病以及肝癌等疾病有關(guān)。
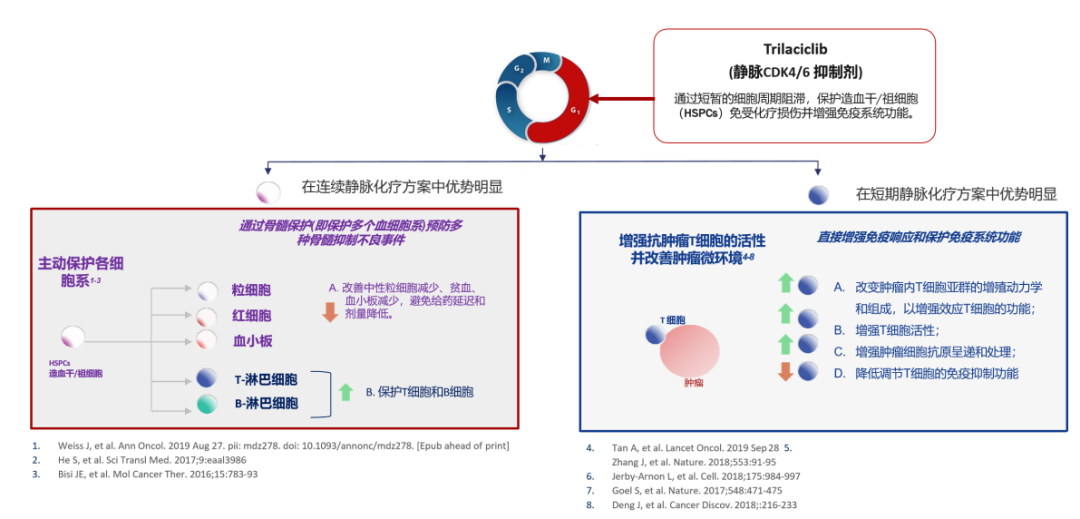
Trilaciclib由G1Therapeutics開發(fā),是全球首個也是唯一一個化療開始前預防性給藥以保護骨髓和免疫系統(tǒng)功能的產(chǎn)品。
Trilaciclib是First-in-class的短效小分子CDK 4/6抑制劑,在化療前預防性使用,可以將骨髓細胞短暫阻滯在細胞周期的G1期,顯著減少化療藥對骨髓細胞的殺傷,保護骨髓細胞和免疫系統(tǒng)功能。

VHL是一種罕見的遺傳性疾病,每3.6萬人中就有1人患病,在美國估計有1萬人患VHL。VHL患者不僅有罹患良性血管腫瘤的風險,也有罹患某些癌癥的風險,包括腎細胞癌。
Welireg是FDA批準的首個HIF-2α抑制劑療法。通過抑制HIF-2α,Welireg可降低與細胞增殖、血管生成和腫瘤生長相關(guān)的HIF-2α靶基因的轉(zhuǎn)錄和表達。
Korsuva由Cara Therapeutics和Vifor Pharma聯(lián)合開發(fā),是一款first in class高選擇性k阿片受體(KOR)完全激動劑,能夠抑制產(chǎn)生瘙癢的外周神經(jīng)元的活性,并且對其他受體(包括mu或delta阿片類受體)、離子通道或轉(zhuǎn)運體無顯著活性。
另外,不同于小分子KOR激動劑,Korsuva是一款小型合成肽,主要激活外周神經(jīng)元(PNS)和免疫細胞表達的KORs。是FDA批準的首個也是唯一一個治療此類患者的療法。
Exkivity由武田開發(fā),是一種專門設計用于選擇性靶向EGFR外顯子20插入突變的強效口服小分子酪氨酸激酶抑制劑。同時也是美國FDA批準的首款專門為攜帶EGFR外顯子20插入突變的NSCLC患者設計的口服療法。
Livmarli是一種每日口服1次的回腸膽汁酸轉(zhuǎn)運體(IBAT)抑制劑,可通過抑制IBAT的再攝取改變膽汁酸的流向,阻斷膽汁酸在肝臟的再循環(huán),增加糞便膽汁酸排泄來防止膽汁酸在肝臟的積聚。Livmarli是FDA批準的首個也是唯一一個治療這種罕見肝病的藥物。
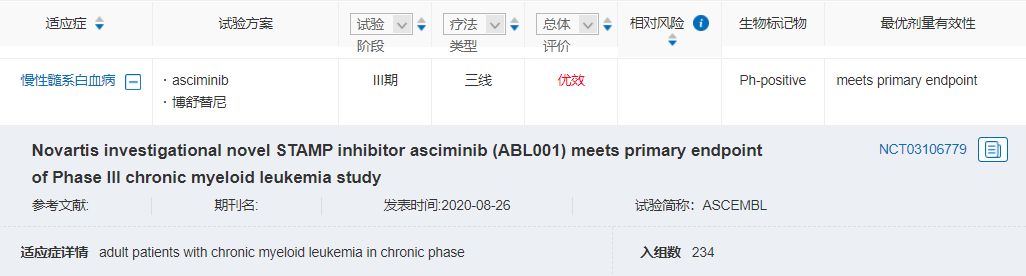
Asciminib是一種專門針對ABL肉豆蔻酰口袋 (STAMP) 的藥物。作為STAMP 抑制劑,asciminib與BCR-ABL1結(jié)合的位點與常見TKI不同,可能有助于解決CML后線治療中TKI耐藥和不耐受問題。
FDA此項批準是基于III期ASCEMBL試驗和I期試驗(NCT02081378)結(jié)果。ASCEMBL試驗結(jié)果顯示,治療24周,asciminib vs 博舒替尼的MMR比率為25% vs 13%。因不良事件導致的停藥率為7% vs 25%。
Tezspire由阿斯利康和安進聯(lián)合開發(fā),是一款first in class生物制劑,通過阻斷TSLP阻止免疫細胞釋放促炎細胞因子,從而預防哮喘發(fā)作和改善哮喘控制。

目前治療哮喘的生物制品只針對T2炎癥,tezepelumab則具有不同的作用機制,能夠阻斷多條炎癥信號通路上游的TSLP,在級聯(lián)的頂端起作用,從源頭上抑制炎癥,從而治療廣泛的嚴重哮喘患者群體。
在國內(nèi),tezepelumab已處于III期臨床階段。開發(fā)TSLP靶向藥的企業(yè)包括康諾亞、和鉑醫(yī)藥、恒瑞醫(yī)藥。
附表:
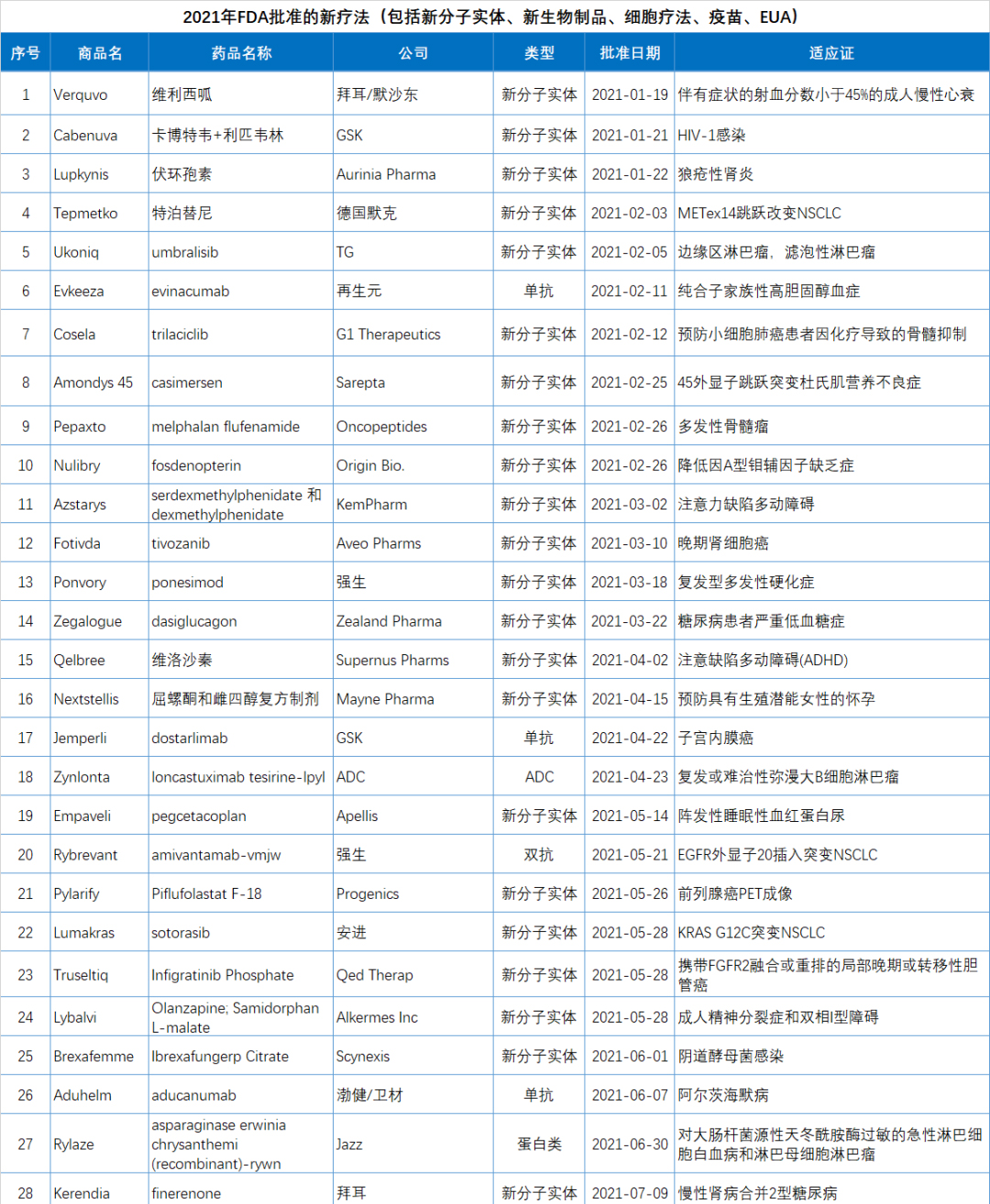

2021年批準的新藥數(shù)量創(chuàng)下了自2016年藥品審評審批改革以來的新高,尤其是中藥新藥在沉寂數(shù)年之后迎來了大爆發(fā),2021年批準了12款中藥,相比之下,NMPA之前2016-2020這5年累計批準的中藥新藥是14款。
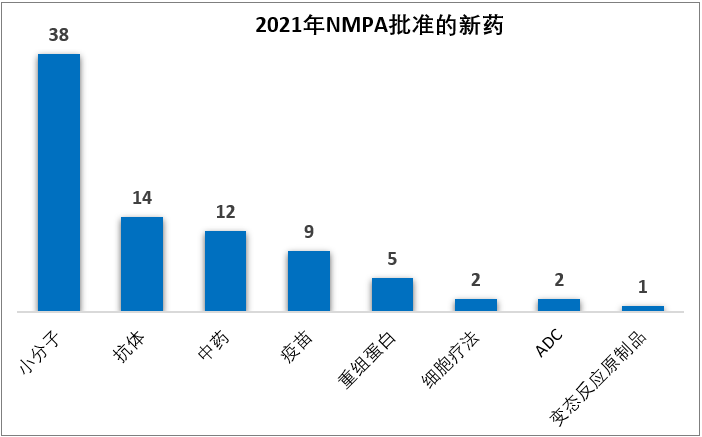
從疾病領(lǐng)域來看,2021年NMPA批準的新藥仍以腫瘤藥居多,占比31%(26/83);其他占比較高的疾病領(lǐng)域還包括感染性疾病(28%,23/83)、內(nèi)分泌代謝(12%,10/83)、神經(jīng)精神(11%,9/83)、血液6%(5/83)。
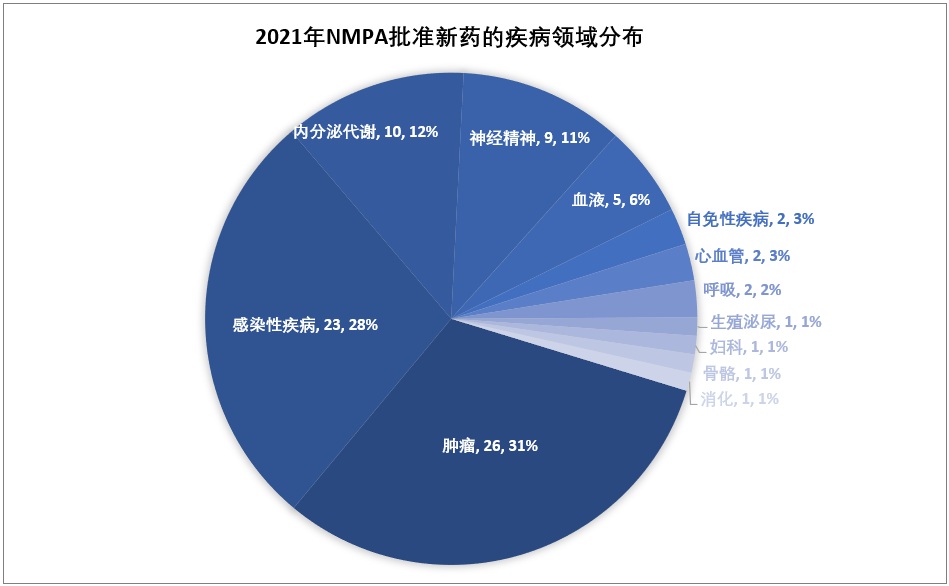
2021年NMPA批準的83個新藥中,有49個是以“優(yōu)先審評”的方式獲批,占比59%,化藥、生物藥、中藥均有涉及;此外,NMPA在2021年批準了12個罕見病藥物(均為進口藥),13個臨床急需用藥。
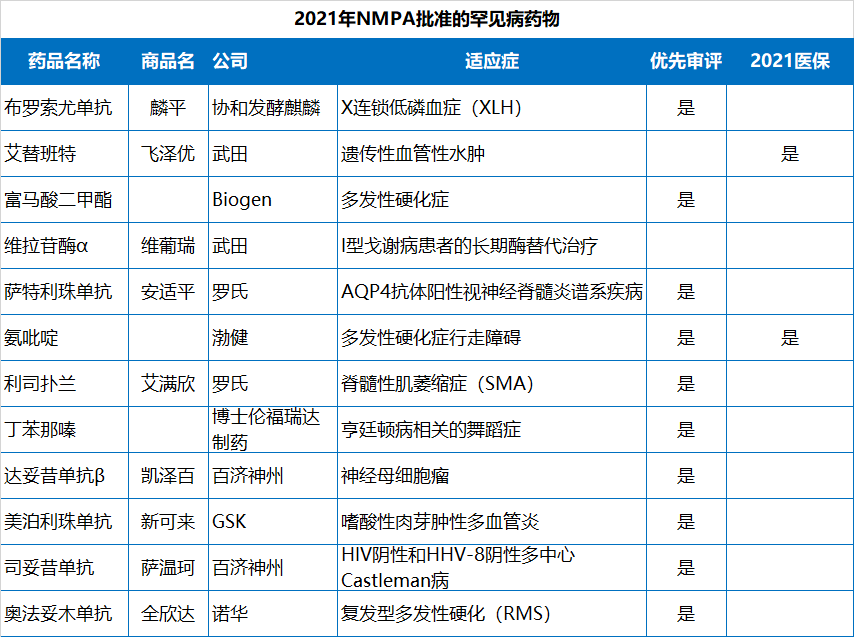
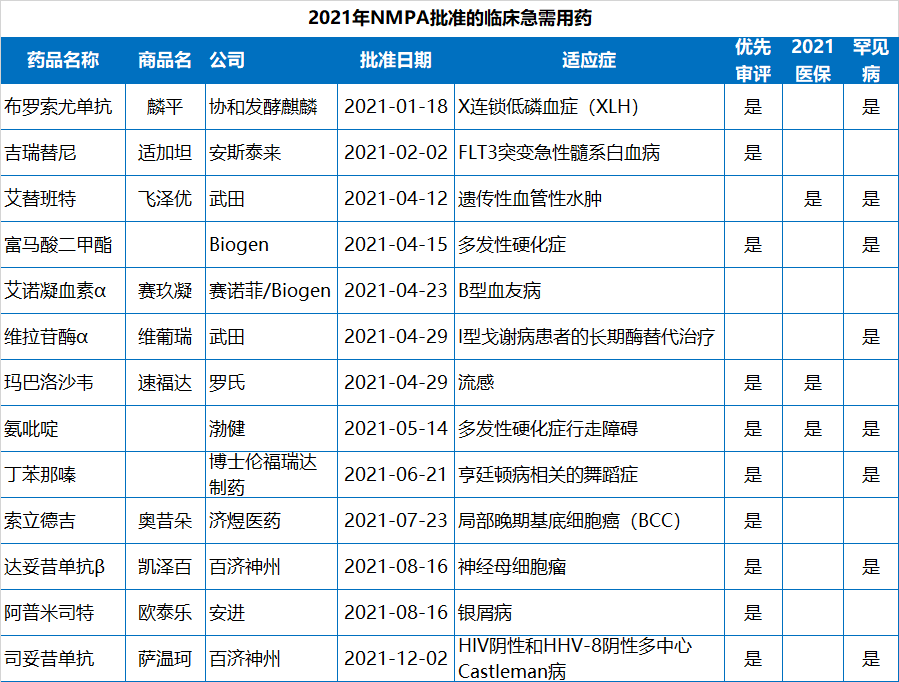
值得指出的是,2021年NMPA批準的83款新藥中,已經(jīng)有19款通過醫(yī)保談判納入了2021年國家醫(yī)保目錄,包括13款國產(chǎn)新藥和6款進口新藥。協(xié)議有效期為2022年1月1日—2023年12月31日。
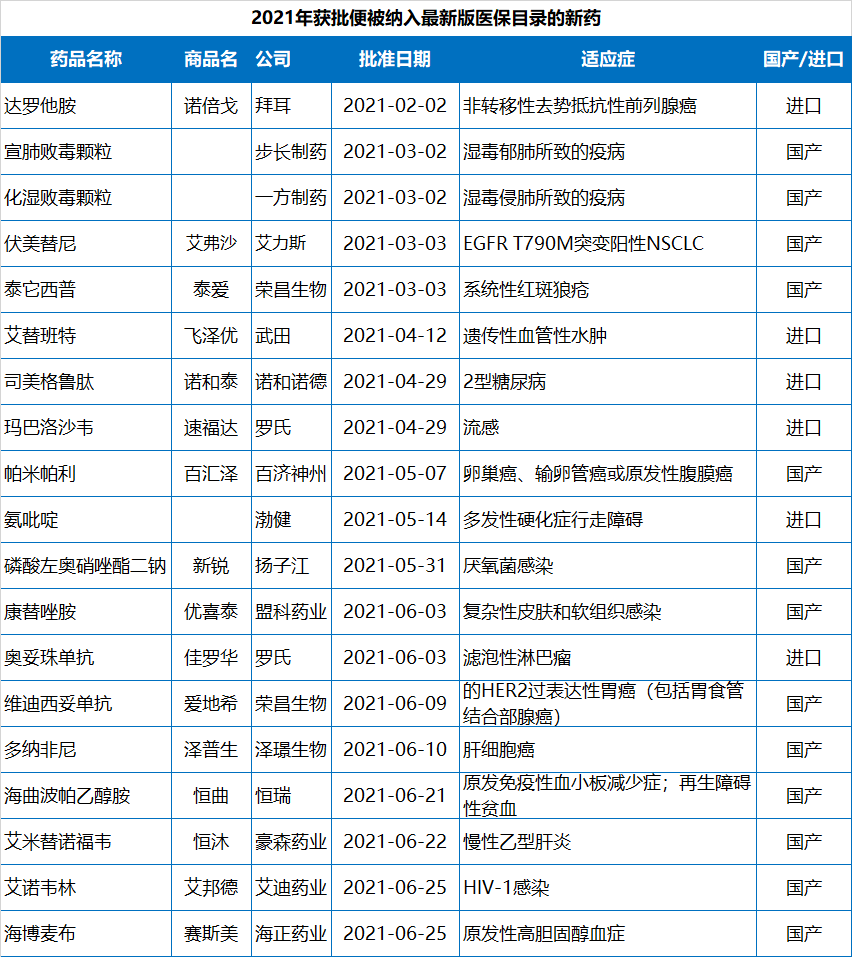
2021年NMPA批準的83個新藥中,有10款曾被CDE納入突破性療法,有10款屬于First in class新藥。有17款新藥是附條件批準上市。
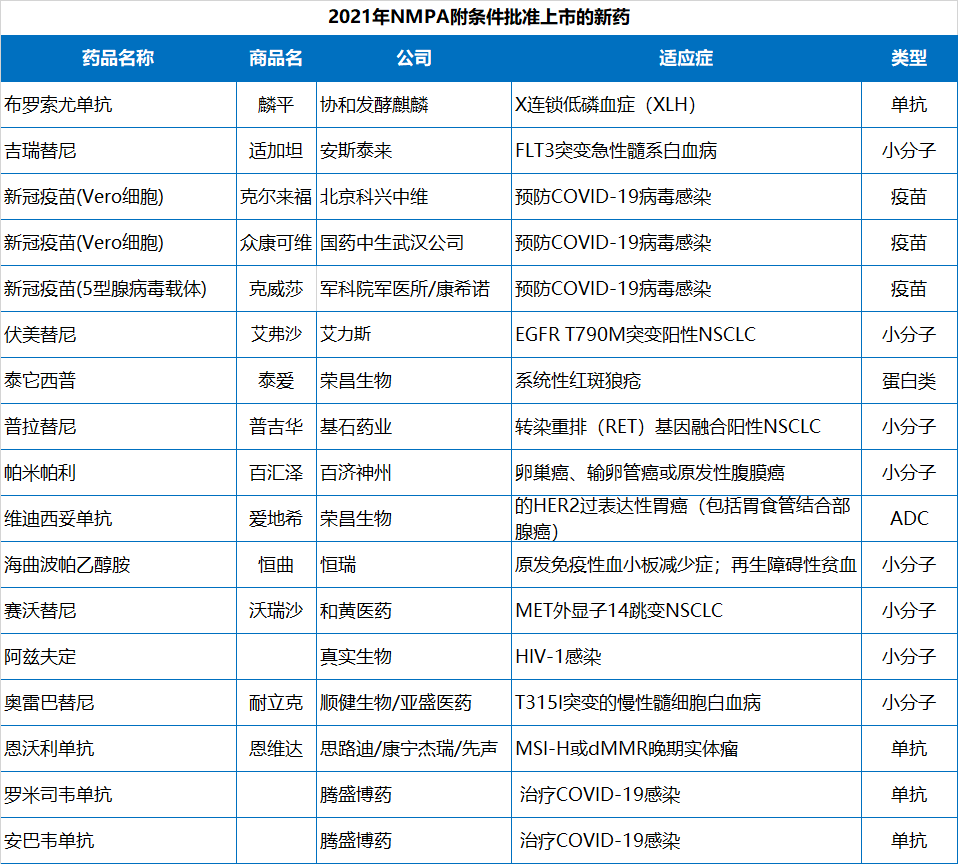
以PD-1/PD-L1為代表的免疫檢查點抑制劑的上市顯著改善了癌癥患者的生存結(jié)局和生活質(zhì)量。然而,PD-1/PD-L1藥物的巨大商業(yè)前景也引發(fā)了me too藥物的扎堆研發(fā),造成同質(zhì)化競爭嚴重。
今年,NMPA共批準了4款PD-1/PD-L1,且全都由本土企業(yè)開發(fā)。分別來自正大天晴/康方生物、譽衡生物、思路迪/康寧杰瑞/先聲藥業(yè)、基石藥業(yè)。截止目前,國內(nèi)已有12款PD-1/PD-L1藥物上市。
2021年NMPA批準的PD-1/PD-L1藥物
隨著醫(yī)藥改革,國家政策和資本對創(chuàng)新藥開發(fā)的支持,我國多款本土創(chuàng)新藥迎來收獲期,且多款藥品都是企業(yè)的首個商業(yè)化產(chǎn)品。
艾力斯醫(yī)藥開發(fā)的三代EGFR-TKI伏美替尼、澤璟生物開發(fā)的首個國產(chǎn)肝癌一線靶向藥多納非尼、德琪醫(yī)藥選擇性核輸出蛋白(SINE)抑制劑塞利尼索、真實生物開發(fā)的首個雙靶點抗HIV-1藥物阿茲夫定、盟科藥業(yè)歷經(jīng)十二年開發(fā)的新一代噁唑烷酮類抗菌藥康替唑胺、亞盛醫(yī)藥的三代BCR-ABL TKI奧雷巴替尼、騰盛博藥/清華大學/深圳市第三人民醫(yī)院聯(lián)合開發(fā)的新冠中和抗體雞尾酒療法安巴韋單抗/羅米司韋單抗、譽衡生物開發(fā)的抗PD-1抗體賽帕利單抗、華昊中天埃博霉素類抗癌藥優(yōu)替德隆等均為這些公司首款獲批新藥。
此外,還有部分本土企業(yè)在今年獲批了不止一款新藥,例如恒瑞,今年連批3款新藥。在2021年的最后一天迎來了公司的第9、10款新藥CDK4/6抑制劑達爾西利和SGLT-2抑制劑恒格列凈,該公司今年6月份獲批的新藥海曲波帕乙醇胺片也順利被納入最新版(2021版)醫(yī)保目錄。
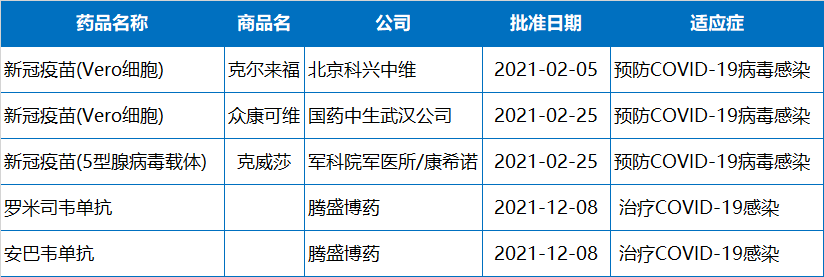
具離新冠疫情爆發(fā)已過去兩年時間,但人類仍在與新冠病毒做著頑強斗爭。在中國,科學家和監(jiān)管機構(gòu)也在努力將新冠治療和預防藥物遞送到人民手中。今年,國家藥監(jiān)局附條件批準了3款新冠疫苗和1款新冠中和抗體,3款疫苗分別來自北京科興中維、國藥中生武漢公司、軍科院軍醫(yī)所/康希諾。新冠中和抗體則來自騰盛博藥/清華大學/深圳市第三人民醫(yī)院。
6月9日,國家藥品監(jiān)督管理局(NMPA)附條件批準榮昌生物自研注射用維迪西妥單抗(Disitamab Vedotin,商品名:愛地希®)上市,適用于至少接受過2種系統(tǒng)化療的HER2過表達局部晚期或轉(zhuǎn)移性胃癌(包括胃食管結(jié)合部腺癌)患者的治療。這意味著中國迎來了首個國產(chǎn)ADC藥物,維迪西妥單抗成為榮昌生物繼系統(tǒng)性紅斑狼瘡新藥泰它西普之后第2個進入商業(yè)化階段的新藥。