

























前天下午(4月27日),博濟(jì)醫(yī)藥首檔線上直播系列課程“博濟(jì)研語”正式開播,第一期課程題目為《如何召開有效的Pre-IND meetings》,由博濟(jì)醫(yī)藥醫(yī)學(xué)總監(jiān)朱飛兵擔(dān)綱主講人。
“Pre-IND meetings起源于美國(guó),在1992年被FDA正式確認(rèn)為加快藥品研發(fā)和審評(píng)審批的流程之一。經(jīng)過近年來不斷的發(fā)展與演變,如今像Pre-IND meetings一樣的溝通交流制度在美不止應(yīng)用于首次臨床試驗(yàn)前,在臨床I期、II期、III期前以及Pre-NAD/BLA期間均有廣泛應(yīng)用。”
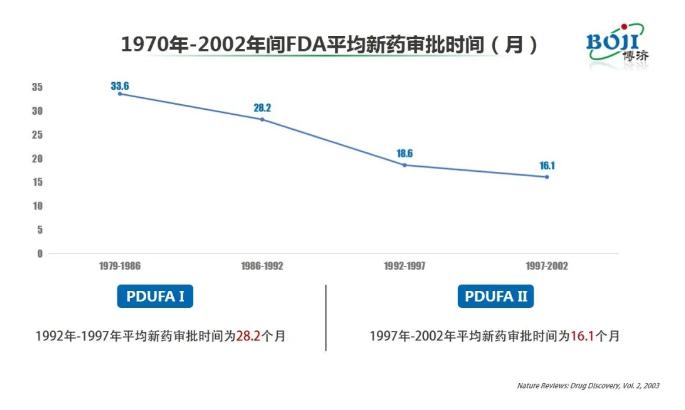
演講伊始,朱飛兵就向廣大網(wǎng)友介紹了Pre-IND meetings的歷史沿襲。在他看來,自形成Pre-IND meetings制度以后,F(xiàn)DA新藥審評(píng)速度明顯加快。數(shù)據(jù)顯示,在1997年-2002年間美國(guó)平均新藥審批時(shí)間為16.1個(gè)月,較此前的1979年-1986年間縮短了50%以上。



是免費(fèi)的,是CDE給我們的福利。但是Pre-IND meetings溝通交流會(huì)的開展是有前提的,當(dāng)線上或非當(dāng)面的溝通無法解決疑問或問題的時(shí)候才有必要或可以申請(qǐng)交流會(huì),建議會(huì)上盡可能討論未解決的問題,以提高會(huì)議效率。
通常從遞交Pre-IND meetings申請(qǐng)到CDE反饋是15個(gè)工作日(適應(yīng)癥團(tuán)隊(duì)討論10日+項(xiàng)目管理人通知5日),告知申請(qǐng)人會(huì)議類型、日期、地點(diǎn)、會(huì)議內(nèi)容,以及藥審中心擬參會(huì)人員等信息。正式會(huì)議從提出日算起,Ⅰ類會(huì)議一般不會(huì)超過30個(gè)工作日,Ⅱ類會(huì)議一般不會(huì)超過60個(gè)工作日,Ⅲ類會(huì)議一般不會(huì)超過75個(gè)工作日。
通過申請(qǐng)人之窗,與CDE的項(xiàng)目管理人聯(lián)系。
一般情況下先確定我們希望召開的會(huì)議類型,特別是Ⅰ類會(huì)議的《溝通交流會(huì)議資料》應(yīng)與《溝通交流會(huì)議申請(qǐng)表》同時(shí)提交,也就是說我們只有拿到數(shù)據(jù)后才能提交申請(qǐng)。Ⅱ類和Ⅲ類會(huì)議的《溝通交流會(huì)議資料》應(yīng)在會(huì)議召開30日前提交,有個(gè)技巧:可以在試驗(yàn)快結(jié)束前就試驗(yàn)中發(fā)現(xiàn)的問題,先準(zhǔn)備明確的問題,并就這些問題提出Pre-IND meetings的申請(qǐng),但應(yīng)計(jì)算好時(shí)間。我們只有拿到數(shù)據(jù)后,并對(duì)這些數(shù)據(jù)進(jìn)行整理后才能去提交《溝通交流會(huì)議資料》,需預(yù)留出30個(gè)工作日,以利于CDE審評(píng)。另外,我們不要提出開放性的問題,比如,問CDE:“這個(gè)藥我應(yīng)該怎么做毒理、藥理試驗(yàn)?”如果這樣,CDE會(huì)回復(fù)按照法規(guī)做就可以了。
如果申請(qǐng)II類會(huì)議,CDE召開會(huì)議的時(shí)限是60個(gè)工作日,不是60天。只要按工作日計(jì)算,這個(gè)策略是可以的。前提是拿到數(shù)據(jù)后,快速準(zhǔn)備好你的支持?jǐn)?shù)據(jù),能夠及時(shí)提交,給CDE去做選擇題,明確相關(guān)問題是否能一同在會(huì)議中討論。但需要注意,采用這個(gè)策略可能會(huì)出現(xiàn)因?yàn)闀?huì)議管理要求無法補(bǔ)充提問,或因?yàn)闆]有與問題相對(duì)應(yīng)的參會(huì)專家而無法在會(huì)中解決新增問題這樣的情況。
我們提供給CDE的應(yīng)該是盡量完整的臨床前動(dòng)物實(shí)驗(yàn)數(shù)據(jù),但并不需要就每個(gè)試驗(yàn)環(huán)節(jié)都提出問題。問題應(yīng)該集中,并只提出我們拿不準(zhǔn)的問題,當(dāng)然,CDE的適應(yīng)癥團(tuán)隊(duì)會(huì)審評(píng)我們的資料,如果沒有搞清楚產(chǎn)品的CMC、藥理、藥效信息等,他們也會(huì)在初步會(huì)前反饋中提出,我們?cè)俜e極回應(yīng)這些問題,將它們拿到正式會(huì)議上討論即可。
這當(dāng)然有。更多內(nèi)容可關(guān)注博濟(jì)子公司:美國(guó)漢佛萊醫(yī)藥顧問有限公司,目前是國(guó)內(nèi)最大的FDA注冊(cè)團(tuán)隊(duì),也是國(guó)內(nèi)首家擁有FDA“電子申報(bào)“能力的公司,公司主要提供:藥品注冊(cè)申報(bào)、臨床前顧問、申報(bào)成功的藥物涉及多種領(lǐng)域,主要包括小分子化藥,雙抗靶點(diǎn)藥物,CAR-T細(xì)胞,植物藥等。目前已有100多項(xiàng)成功案例。

