

























防控降級、復工復產、景區開放、學生復課......經歷了近4個月的新冠疫情防控阻擊戰,中國的疫情防控取得了階段性成效,全國上下正處于全面恢復社會經濟秩序的新階段。
反觀大洋彼岸的美國, 當前卻是“ 一地雞毛” 。截至5月20日,美國新冠病毒累計確診病例超154萬例,占全球確診病例的近三分之一;累計死亡病例增至逾9.3萬例,占全球死亡人數的四分之一以上。
面對如此嚴峻的抗疫局勢,作為保護美國公眾免于生物、化學、放射性/ 核威脅和新發流行性傳染病威脅的醫療產品監管部門,FDA是如何使用法律機制加快醫療應對產品的緊急使用?又是如何審評疫情相關藥品、生物制劑、疫苗和器械的安全性和有效性?再又如何與政府其他部門協同防范公共衛生威脅并作出反應?
日前,博濟醫藥子公司美國漢佛萊法規部副總裁陳謹博士作客“ 博濟研語” 直播間,以《美國面對緊急疫情的政策準備》為題,向廣大網友介紹了美國FDA面對重大公共衛生緊急事件的相關舉措以及應急使用相關醫藥產品的評審政策。
重大公衛事件中,FDA到底在做什么?
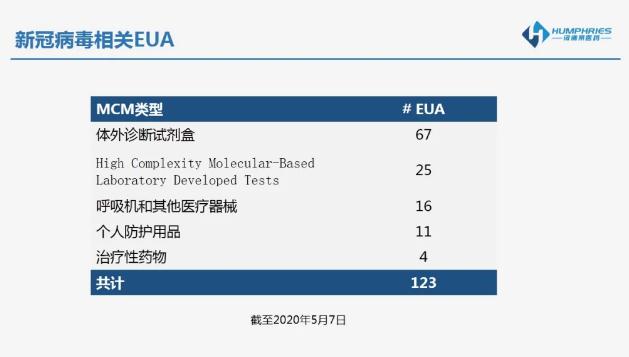
EUA到底有多強?
(1)出現由特定的化學、生物、輻射或核放射物等因素引發的嚴重公衛挑戰或嚴重人類疾患;
(2)必須有理由相信,EUA覆蓋的產品必須對上述人類疾患具有預防,診斷或治療的功效;
(3)應該能夠對EUA所覆蓋產品的安全性和有效性在短時間內作出正確合理的初步評估;
(4)目前市場上沒有可以應對上述人類疾患的充足產品或替代產品。
公衛事件終止后,
那些在研用藥何去何從?
FDA應對嚴重公衛事件政策究竟有何措施



