

























表2. 對于經監管級、科學級或研究級驗證的分析方法在研究中樣本分析的接受標準
參照(比)標準物
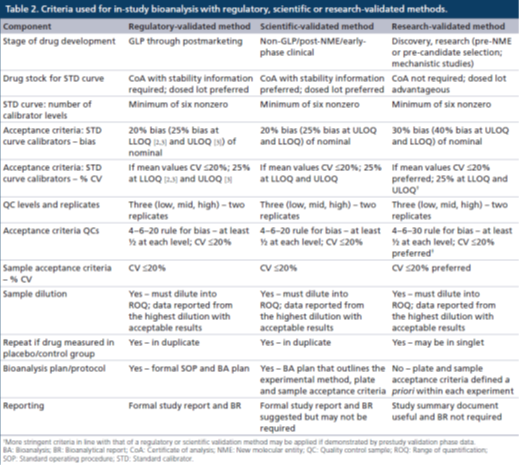
研究級:對于研究級的方法驗證,允許使用沒有CoA的參照(比)標準物,即比較標準物(comparator),或未表征的標準物(uncharacterized standard),特別是在無法獲得完全表征的標準物的時候,例如在藥物發現或開發早期。在更早期階段,由于藥物生產和隨后的研究的時間安排以及可用的藥物數量往往無法對生物藥物原液進行完整的表征,為了使人們對分析結果有更大的信心,在可能的情況下最好使用與動物研究中使用的相同批次藥物作為參照(比)標準進行樣本分析。
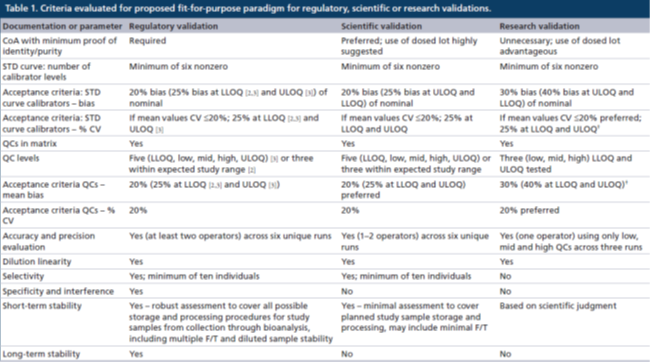
監管級驗證:對于校準曲線的準確度和精密度的評估應該在6次獨立運行中進行且持續幾天,在驗證期間由多位分析人員執行。
經監管驗證的方法必須具有至少6個非零校準點濃度的STD,其中至少75%的校準點濃度的準確度(偏差bias)和精密度(%CV)均應≤20%。在LLOQ和ULOQ校準點水平上:準確度≤25%偏差,精密度≤25%CV。錨定點可以用于取得最佳的曲線擬合,但是其濃度超出了定量范圍(ROQ),因此不用于對校準曲線的評估。用于研究前方法驗證的非線性曲線擬合和加權方式也必須應用于研究中樣本分析,樣本分析對STD準確度和精密度的要求與驗證階段相同。不能對LLOQ以下或ULOQ以上的未知樣本濃度結果進行外推計算。
監管級驗證還要求使用5個質量控制樣品(高質量控制點[HQC]、中質量控制點[MQC]、低質量控制點[LQC](在LLOQ校準點濃度的3倍以內)、該方法的LLOQ[LLOQ QC]和ULOQ[ULOQ QC]),或者使用預期研究樣本濃度范圍內的至少3個質量控制點濃度來評估分析方法的準確度和精密度。偏差和%CV的接受標準均為≤20%,在LLOQ和ULOQ校準品水平上,偏差≤25%,%CV≤25%。QC的可接受總誤差(總偏差和%CV之和)為≤30%,HQC、MQC和LQC QC的可接受總誤差≤30%,LLOQ QC 和ULOQ QC可接受總誤差為≤40%。
在研究中樣本分析時,一般使用3個水平的QCs(HQC、MQC和LQC)進行復孔分析,準確度和精密度的偏差和%CV均需≤20%。如果每個校準點(復孔分析)的50%和6個QCs中的至少4個滿足上述標準,則該分析運行可以接受,這符合“4-6-20”規則。
科學級驗證:在進行研究前科學級驗證的過程中,STD曲線評估以及準確度和精密度評估可以由一名或兩名分析師在2天內完成,可用來減少研究前階段的持續時間。這與監管級驗證所需要的更穩健評估相反,但是是可以接受的,因為它反映了該方法只是短期地應用于樣本分析。科學級驗證的研究前驗證和研究中樣本分析的目標接受標準與監管級驗證的目標接受標準一致,但基于數據的預期用途等科學原因,可能會應用更寬泛的接受標準(例如>20%偏差和 %CV >20%)。在后續的"討論"章節中,所有的接受標準都表示目標/預期接受標準。
在經過科學驗證的方法中,校準曲線也應該至少包括6個非零校準點濃度。準確度和精密度的偏差和%CV目標均應≤20%(對LLOQ和ULOQ校準點:偏差≤25%,%CV≤25%)。研究前科學級驗證應使用5個級別的QCs (HQC、MQC、LQC、LLOQ QC和ULOQ QC)或者預期研究樣本濃度范圍內至少有三個QC濃度,準確度和精密度的目標偏差和%CV均≤20%(LLOQ和ULOQ:偏差≤25%,CV≤25%),HQC、MC和LQC的目標總誤差為≤30%(ULOQ QC和LLOQ QC為≤40%)。
在樣本分析時,應使用三個級別的QCs(HQC、MQC和LQC,復孔分析),其準確度和精密度的目標偏差和%CV均≤20%,如果每個校準點(復孔分析)的50%和6個QCs中的至少4個滿足上述接受標準,則該分析運行可以接受,這符合“4-6-20”規則,也適用于監管級驗證的分析方法。
應該注意的是,如果在科學級驗證的研究前驗證階段,更寬泛的接受標準被證明是合理的,并適用于STDs和QCs的準確性和精密度,那么在樣本分析階段,這些更寬泛的接受標準也應該適用于分析運行的接受。
研究級驗證:研究級驗證的準確性和精密度以及STD評估應由一個分析人員在3次獨立的運行中進行評估,這表示研究級方法驗證的嚴謹性降低了,但這卻是可以接受的,因為它反映了該方法只是有限地用于樣本分析,以支持內部的早期決策。
研究級驗證的研究前驗證和研究中樣本分析的目標接受標準應該比基于科學級或監管級驗證(例如偏差>20%和%CV>20%)更為寬松。更寬泛的準確性和精密度接受標準可用于對STDs的評估(例如30%偏差,在LLOQ和ULOQ可以有40%偏差)。在另一方面,如果STD的表現說明可以達到更嚴格的接受標準,則應該使用監管級或科學級驗證中采用的目標接受標準或者其他更嚴格但合理的接受標準。
研究級驗證中,應評估至少3個級別的QCs(HQC、MQC和LQC),其準確度和精密度的目標接受標準為偏差30%和CV20%以內。這是可以接受的,因為這三個QC的使用提供了對經研究級驗證的方法效能的充分控制。如果開發階段數據表明可以滿足更嚴格地接受標準,則應采用監管或科學級驗證標準或其他更嚴格的接受標準,應該測試LLOQ和ULOQ QCs以供參考,但不需要設立接受標準。
對于使用經研究級驗證方法進行的樣本分析,如果在研究前驗證時,使用了更寬泛的接受標準,則可以擴展用于經監管級和科學級驗證的“4-6-20”規則。應該評估3個級別的QCs(HQC、MQC和LQC,復孔分析)。HQC、MQC和LQC的6個稀釋QCs中必須有4個回算到其標稱值的30%以內(“4-6-30”規則);在接受了的QCs中,必須有4個QCs的%CV≤20%。如果在研究前驗證階段使用了更嚴格的接受標準,則在樣本分析期間也必須采用那些標準。
監管級、科學級或研究級:通常,許多LBA方法的ROQ有限,因此有必要對高濃度樣本進行(多次)稀釋,以使其進入到ROQ之內。對于所有級別的驗證,都有必要證明濃度接近或超過最高劑量水平的預計最大濃度(Cmax),或大于分析方法的既定ULOQ的樣本,可以稀釋進入既定的ROQ。
為了評估稀釋線性度,將已知的待測物加入到空白混合樣本基質中來制備濃度在Cmax或附近(或高于ULOQ)的樣品,然后稀釋這些“稀釋線性樣品”,使稀釋后的濃度落在ROQ之內。如果回算的稀釋前濃度在標稱濃度的20%以內,則該方法的稀釋線性度對于需要進行監管驗證的方法是可以接受的。對于科學級和研究級驗證,可以使用更寬泛的接受標準 (即驗收標準與QC樣品相同)。
此外,稀釋線性實驗還能夠識別可能的"鉤狀效應",需要評估鉤狀效應(prozone effect)以便為研究中樣本分析確立一個合理的稀釋方案。在經科學級或研究級驗證的方法支持的研究中,分析方法規定的最低稀釋倍數(MRD)下如果預期的Cmax不高于ULOQ,那么所有樣本分析均可在單一稀釋倍數下進行,這意味著可能不需要評估稀釋線性度,同一微孔板上QCs的稀釋足以證明這一點。
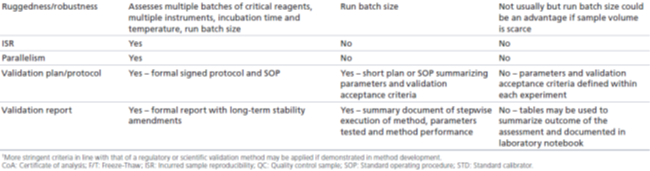
監管級:對于需要監管級驗證的方法,在研究前評估生物基質中待測物的穩定性是至關重要的。穩定性評估應涵蓋在研究期間所有預期的樣本儲存條件,包括臨床或動物實驗期間、運輸期間任何中間地點和PK生物分析實驗室。長期穩定性必須至少涵蓋從樣本采集到生物分析完成之前,任何研究樣本在相關儲存條件下的儲存時間。此外,還必須評估預期的樣本處理過程中的穩定性,包括冷凍-解凍穩定性、工作臺穩定性(或樣本處理條件)以及如果在分析前進行樣本處理,處理后樣本的穩定性。已建立的穩定性應達到或超過研究樣本的實際處理時間和條件。至少應該在HQC和LQC水平上評估樣本的穩定性,并與新制備的STD和QCs進行比較。如果穩定性樣本的分析數值的偏差在15%或20%范圍內,則滿足穩定性的接受要求。
科學級:經科學級驗證的分析方法的生命周期通常很短,而且參照(比)標準物本身的穩定性往往沒有很好地建立起來。參照(比)標準物穩定性數據的缺乏也意味著沒有必要研究待測物在生物基質中的長期穩定性,建議只進行短期穩定性研究,以便于在樣本分析時合適地存儲和處理研究樣本。因此,在研究前驗證階段,通常建議在計劃的儲存條件下進行有限的冷凍-解凍測試和短期的穩定性研究(數周或數月,而不是數年)。如果在研究開始前,預知需要某些獨特的存儲環境,則應在研究前階段評估那些條件下的穩定性。與監管級驗證一樣,至少應在HQC和LQC水平上評估穩定性在科學級驗證中使用的接受標準,可用于穩定性樣品(但是如果對驗證QCs使用更寬泛的接受標準,那這也適用于穩定性樣品)。
研究級:經研究級驗證的方法的生命周期特別短,因為許多使用這些方法的研究也是短期的。參照(比)標準物的穩定性一般未知,因此也不需要長期穩定性數據,常規地(routinely)評估短期穩定性,應該只有在對待測物的經驗有限的情況下進行。如果存在已知或疑似的藥物不穩定性,那么了解它們對樣本分析結果的影響很可能是有益的。因此,建立樣本的基本穩定性如凍融或有限的工作臺穩定性,以進行樣本處理,會有助于獲得可靠的分析結果。如果需要評估穩定性,至少應該在HQC和LQC水平上進行,研究級驗證中使用的接受標準應適用于接受穩定性樣品(如果對驗證QCs使用更窄的接受標準,這也適用于穩定性樣本)。
監管級:相關指南文件沒有直接探討穩健性和耐用性評估。但是,從行業的最佳實踐白皮書中可以得知,監管級驗證經常有包括此類評估,以確保該方法在實驗室通常可能發生的條件下產生可重現的結果。評估穩健性時,需要引入特定的變化(如孵育溫度、孵育時間、光照或基質),然后研究該方法的一致性(consistency)。此外,一般通過研究下述內容來評估該分析方法的耐用性:正常進行分析過程中可能出現的不同操作條件,如不同的分析人員、不同的儀器或試劑等,建議進行運行大小的測試(batch size testing)。穩健性和耐用性評估應該反映預期的操作條件和潛在的變化,而該分析方法在其整個生命周期內會在這些操作條件下或潛在變化真的發生時被使用。
科學級:經科學級驗證的方法,不需要像監管級驗證方法那樣在多個分析人員、設備和持續時間上展示相同水平的穩健性,因為這些分析方法的生命周期更短,因而預期的變化更少。經科學級驗證的方法在進行樣本分析的實操條件時,穩健性和耐用性評估會幫助提供足夠的信心來使用該方法,但無需在這些條件之外進行更多的評估。因此,如果一個分析人員正在對有限的設備進行研究前驗證和研究中樣本分析,并有足夠的試劑來完成整個分析任務,則穩健性評估可能僅限于運行大小的測試,以確保微孔板的批量處理足以支持樣本分析。
研究級:由于經研究級驗證的方法的應用非常有限,因而對研究級驗證的分析方法一般不需要評估其穩健性和耐用性,但如果要分析大量的或體積有限的樣本,則評估運行大小(batch size assessment)可能是有益的。
監管級:必須證明需要監管級驗證的分析方法對待測物具有選擇性,以證明基質成分不會干擾分析結果。應該使用至少10個單體的空白生物基質,并在LLOQ水平上外加該生物藥,以評估分析方法的選擇性。評估外加待測物(接近LLOQ濃度)樣品的回收率,以確保基質效應不影響該方法在上述濃度的回收率。如果可能,建議在相關疾病狀態的生物基質中評估回收率,并且也對基于血清或血漿的分析方法、對高血脂或溶血樣本評估回收率。如果在10個樣本中8個外加待測物的回收率在標稱值的25%的偏差范圍內,并且對未外加待測物的樣本所測定的待測物濃度小于LLOQ,則該分析方法的選擇性評估符合接受標準。如果此評估的結果,在方法開發階段發現不可接受,則建議在驗證之前提高LLOQ的濃度。
科學級:需要經科學級驗證的方法應該評估其選擇性,與監管級驗證一樣,評估應包含10個單體的生物基質樣本,并且要評估外加和未外加待測物的樣品。相反,并不需要對高脂質或溶血樣本(血清或血漿樣本)評估選擇性。另外,只有在疾病狀態已知會引入干擾物質的情況下,才建議評估疾病狀態的生物基質。接受標準與監管級驗證一致:80%的樣本的回收率偏差需要在25%之內。
研究級:對于研究級驗證,不需要全面地評估選擇性,因為在測試LLOQ QC樣品時,已經在混合基質中進行了近似的選擇性評估。如果某個動物中存在所服用的藥物的內源性同源物或其他有科學原因,則可在較少數量的單體基質樣本中評估選擇性。用于STD曲線中LLOQ的接受標準也適用于選擇性樣品。
監管級:對于需要監管級驗證的方法,需要證明用于測試的試劑僅與該生物藥即待測物結合,并且不與其他相關化合物或伴隨藥物發生交叉反應。應在該方法的LLOQ和ULOQ水平上,用QCs評估特異性。例如結構相似的生物藥、抗藥物抗體、可溶性藥物靶點、已知的伴隨藥物等,偏差在25%以內的QCs即滿足可以接受的特異性。應將已證明的干擾物質記錄在案。另外,如果干擾物妨礙了PK數據的適當解釋,則需要在方法驗證之前,采取措施(如重新開發該方法)以減輕其影響。
科學級:對監管級驗證的方法,必須評估其特異性,但對于科學級驗證來說則不是必須的。一般來說,需要科學驗證的方法無需費力地開發分析方法,以減輕來自抗藥物抗體(ADA)或可溶性靶點的干擾,因為嚴格證明該方法可接受的要求太高,除非相關干擾非常普遍,且妨礙了基本的PK數據解釋。
研究級:可省略特異性測試。對研究級驗證的方法,無需全面地描述或減輕干擾,因此不需要評估方法的特異性。
監管級:由于研究前驗證所用的STDs和QCs可能不能完全模擬研究樣本的性能,作為監管機構的要求,ISR是為了確保所報告的樣本濃度的可靠性,且視為準確性的模擬評估。對于1000個樣本以內的研究,ISR需要測試10%的樣本;而對于1000個樣本以上的研究,應進行5%的ISR測試或者測試7%的所有研究樣本。這些樣本應來自Cmax附近和藥物消除階段。在這一評估中,ISR樣本在另一個日期重新測試(重復repeat),以模擬最初的生物分析(原始original)。該評估比較重復(repeat)和原始(original)測定結果之間的百分比差異,如果二者結果相差≤30% ,則認為樣本的測定結果是可以接受的。如果2/3的測試樣本(67%)符合樣品接受標準,則整個評估合格。如果評估失敗,必須進行調查以確定失敗原因,并采取適當措施,盡量減少不準確的結果。
此外,還應該使用ISR樣本評估方法的平行性。平行性在概念上類似于稀釋線性,但使用實際研究樣本進行連續稀釋,單個樣本之間的個別基質成分的差異可能會干擾測定結果。雖然FDA指南草案規定,“稀釋后研究樣本的平行性應使用稀釋后的校準品進行評估,以檢測基質效應”,但沒有就接受標準提出指導。EMA指南對評估樣本平行性的期望提供了更多信息:"應使用空白基質稀釋高濃度的研究樣本(最好接近Cmax)到至少三個濃度。稀釋系列中樣本之間的精密度不應超過30%。”因此,應選擇在Cmax附近的研究樣本并連續稀釋,使得至少三個稀釋濃度在方法的ROQ內。如果稀釋結果回算后濃度的%CV≤30%,則樣品符合驗收要求。如果評估失敗,必須制定一個計劃,說明如何報告稀釋樣本的測定濃度。
科學級:對于經科學級驗證的方法,常規的話不會在研究中對ISR和平行性做一步的驗證/評估。如果在研究中樣本分析過程觀察到樣本稀釋的非平行性,則可以按照與監管級驗證相同的設計和接受標準來評估平行性。監管級驗證的指南文件規定:對支持人體生物等效性研究、關鍵PK或PD研究以及非臨床安全性研究必須評估ISR和平行性,這些研究的結果將被納入向監管機構提交的文件。科學級驗證并非是為了長期應用該分析方法而驗證的,使用該類方法的主要目的是支持非GLP(non-GLP)或非關鍵性研究,這些研究的數據不會用于支持監管申報文件中的主要結論。
研究級:經研究級驗證的方法僅會短期使用,主要用于候選藥物的選擇或早期臨床前研究,其數據僅用于內部決策。因此,不需要評估ISR和平行性,除非特別有必要。
本文如有疏漏和誤讀相關指南和數據的地方,請讀者評論和指正。所有引用的原始信息和資料均來自已經發表學術期刊, 官方網絡報道等公開渠道, 不涉及任何保密信息。參考文獻的選擇考慮到多樣化但也不可能完備,歡迎讀者提供有價值的文獻及其評估。

