

























乙肝是由一種包膜DNA病毒-乙肝病毒(HBV)感染肝臟引起的肝細(xì)胞壞死和炎癥,乙肝表面抗原持續(xù)陽(yáng)性6個(gè)月或以上則定義為慢性乙肝(CHB)。慢性乙肝的主要并發(fā)癥為肝硬化和肝細(xì)胞癌,大約20%到30%的慢性感染者會(huì)出現(xiàn)這些并發(fā)癥。
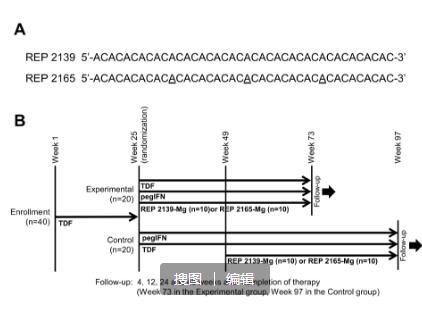
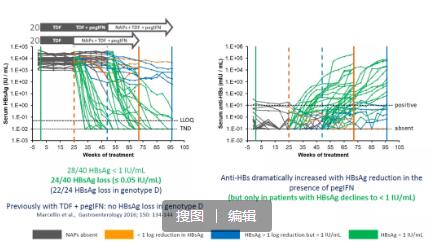
博濟(jì)醫(yī)藥結(jié)合自身在肝臟疾病研發(fā)領(lǐng)域擁有的豐富項(xiàng)目經(jīng)驗(yàn)和專家資源,將NASH和乙肝新藥臨床研究列為公司重大項(xiàng)目和重點(diǎn)發(fā)展業(yè)務(wù)。博濟(jì)醫(yī)藥已成立特色的肝病臨床研究團(tuán)隊(duì),由肝病專業(yè)特長(zhǎng)的專家和骨干組成,旨在打造一支肝病領(lǐng)域的標(biāo)桿團(tuán)隊(duì),高質(zhì)高效服務(wù)客戶。

