上周,“袁來如此”專欄就LBA定量方法的監管驗證展開了第一期詳細介紹,圍繞歷史視角、文件記錄要求、測試試劑的選擇、穩定性、測試格式和運行/批次大小(batch/run size)、參照(比)物(REFERENCE MATERIAL)特異性(specificity)和選擇性(selectivity)等方面的內容進行分享,本期將延續上期內容,繼續分享后續相關內容。
樣本基質的選擇、樣本制備和最低稀釋倍數(MINIMUM REQUIRED DILUTION,MRD)選擇基質時的考慮因素,是小分子開發的分析方法與為大分子藥物開發LBA定量分析方法之間的關鍵區別之一。小分子分析方法通常包括一個分析前的萃取步驟,該樣本前處理步驟通常有助于減輕單個基質的變異性所帶來的問題。
而蛋白待測物的固有特性使得在樣本分析之前做萃取很難,通常是完全無法萃取。因此,通常所開發大分子定量方法無需萃取,即可測定復雜生物基質中的待測物。然而,在可能存在內源性蛋白待測物的情況下,必須仔細地考慮基質的選擇和數據分析。
方法開發階段
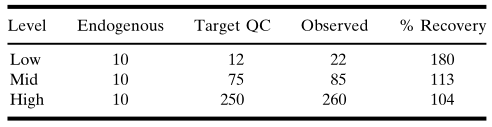
所收集的生物樣品中的待測物存在于不同的基質中,包括血漿、血清、尿液、腦脊液(CSF)、關節滑液和均質化的組織。由于待測物的特性會受到樣本制備方法影響,因此必須在樣本采集過程中評估如下因素:所需要的任何添加劑(抗凝劑、蛋白酶抑制劑等)、待測物的穩定性(血漿或血清分離前的全血)、樣本收集后的處理和儲存條件(溫度、瓶型等)。測試格式、樣本收集條件和其他因素可能會影響基質的選擇,例如如果使用自動化樣本處理系統,則血清將是首選的基質,因為血漿中通常含有血纖維蛋白凝塊,可能會干擾移液操作。相比之下,血漿是不穩定待測物的首選基質,因為制備血清所需的時間較長,而且存在蛋白水解酶(proteolytic enzyme)降解蛋白的問題。本文稍后將對樣本收集后基質中的待測物進行更確切的穩定性評估。加標樣品(spiked sample)的基質應當與預期的未知研究樣本的基質相同,要使用相同的基質制備標準品(標/校準品,standard/calibrator)。當在基質中檢測不到內源性信號時,簡單地加標/回收研究就足以確定合適的空白基質。在這些條件下,建議使用標稱濃度(nominal concentration)。相反,當基質中存在可定量的內源性物質,并且內源性物質和外加待測物的回收率是累加式(線性)的時候,可以應用一個校正因子(例如內源性濃度4ng/mL,加標分析物為6ng/mL,累加效應為10ng/mL)。在這種情況下,可將所測定的內源性濃度與所添加的待測物濃度(標稱值)相加來得到指定值(assigned value)(表IIA和表IIB)。表IIA.內源性蛋白累加貢獻效應的示例。在這種情況下,內源性蛋白的影響可以在低質量對照樣品(QC)中觀察到;但其對中、高水平質量對照樣品的影響不大。
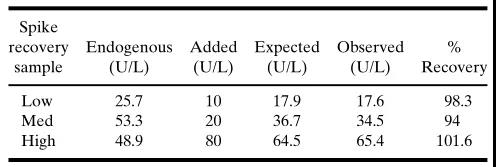
表IIB. 當等體積的基質和QC加在一起時,內源性蛋白累加(線性)貢獻的示例。方法:50mL含內源性藥物的基質(25.7U/L)+ 50mL 標準品10(10U/L)= 期望值17.9U/L(相互以1:2的比例稀釋:12.85U/L+ 5U/L= 17.85U/L)
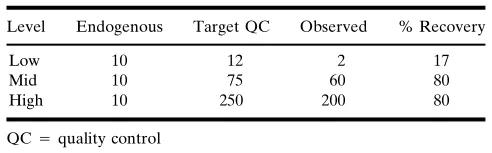
另一種選擇是減去內源性濃度,該濃度是用正在驗證的分析方法或一個正交的(orthogonal)分析方法所測定的。這種方法需要分析空白樣品(另外加待測物),這樣就可以減去內源量,并計算出外加的標稱量。當內源性濃度和外加的待測物濃度不是線性關系時,就不能用數學方法將這兩個濃度相加,因而只能報告測定的(觀察到的)濃度(表IIC)。或者可以在外加待測物之前,剝離空白基質中內源性蛋白。
表IIC. 內源性蛋白非線性貢獻的例子。觀察到的藥物濃度與“空白”基質中的內源藥物量或外加的“目標”濃度均不是線性相關。在這種情況下,觀察到(測定)的濃度是唯一可以放心使用的數值。
通常不推薦使用剝離了內源物的基質或替代基質,但在無法設計其它策略來定量內源物時,則是必要的。使用木碳(charcoal)剝離的基質,很難保證基質的其它方面不發生變化。如果使用配體親和層析剝離內源物,配體的溶出可能會干擾該分析方法。無論基質干擾的來源如何,制備QC樣品時,必須使用與研究樣本類型一致的、純粹且未改變的基質。除了保證待測物的穩定性外,在純粹基質(neat matrix)中制備QC樣品還可用于同時測定分析方法的精密度和準確性。
當難以獲得生物基質(例如關節滑液、腦脊液)時,可以用一個替代基質(substitute matrix)來制備標準曲線。應嘗試使用真實樣本基質制備至少一個級別的QC樣品,以證實基質效應沒有影響準確度,即沒有均值偏差(mean bias)。分析方法所需的最小稀釋倍數(MRD)是必須稀釋樣本的最小稀釋倍數,是為了在分析時使用規定的標準品和樣本稀釋液,以達到最優的準確度和精密度。在某些情況下,如當標準品是在100%的血清或血漿中制備時,則不存在MRD,可以直接分析未稀釋的純粹樣本。在其它情況下,如果內源性物質沒有產生線性信號或觀察到的背景信號不是由于內源性的分析物(例如,heterophilic antibodies,風濕因子)增加影響的,則可能需要稀釋樣本,以建立可接受的線性關系。為了克服信噪比的問題,所有的樣本都必須以某個倍數進行最低限度的稀釋,以取得更高的重現性和準確度。研究前驗證階段
在方法開發過程中所選擇的生物基質將用于制備研究前驗證所用的標準品和驗證樣品。一旦在方法開發過程中解決了基質的影響,就不需要進一步的驗證,但驗證報告中應該包括對該解決方法的討論。如果使用的是經過剝離的基質,驗證樣品則必須在同樣的基質中制備,以評估精密度和準確性。在方法開發過程中選擇的MRD也將在研究前驗證中得到確認。研究中驗證階段
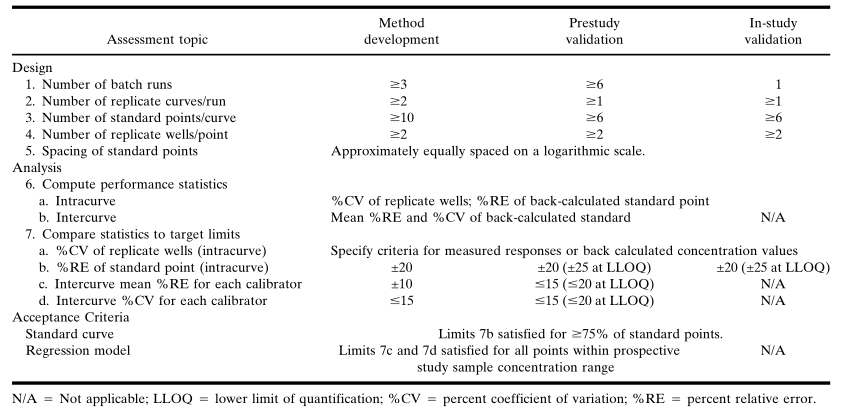
在研究中驗證時,除了在觀察到基質干擾時需要額外稀釋樣本外,沒有與樣本制備相關的接受標準。由于潛在的基質干擾而導致重新分析樣品時,應當預先設定并常規地應用相關指導原則。在基質批次變化的情況下,應當制備相同濃度的QC樣品,證實與研究前驗證數據的可比性,然后繼續進行樣本分析。標準校準物(STANDARD CALIBARTOR)和標準曲線將已知數量表征良好的標準參照(比)物(待測物,analyte)加入到適當的基質中制備標準校準品,在既定的分析條件下生成并得到濃度-響應關系,即標(校)準曲線(standard curve)。根據這個標(校)準曲線,未知樣品中分析物的濃度可以通過內插方法計算。在方法開發過程中,應當建立標準品的濃度和將一條曲線擬合于校準數據的回歸模型,此模型需在研究前驗證期間得到確認,并在分析研究樣本時使用。表III匯總了評估標準曲線數據設計和分析回歸模型的建議,將使用表IV中的研究前驗證的標準曲線數據說明統計分析的過程。表III. 標準曲線評定標準. (未包括“錨定點”)
表IV.一個研究前驗證的標準曲線響應值
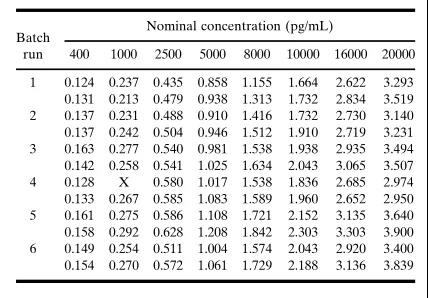
方法開發階段
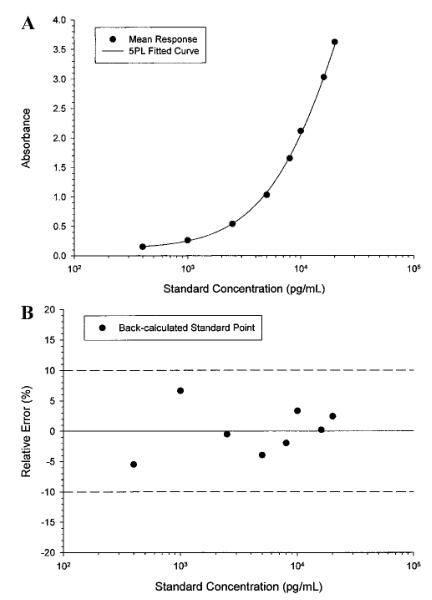
由于標準點濃度在方法驗證開始后不應改變,因此在方法開發過程中應包括更多的標準點(standard point)和重復點(replicates),以便盡早地詳細研究濃度-響應關系,盡可能地實現為回歸模型提供可靠的評估。標準參照(比)物濃度點的范圍應包括稀釋后研究樣品的濃度,并在對數刻度上近似均勻地間隔。建議至少有10個非零標準濃度點(復孔,duplicate)用于濃度-響應關系,用于其早期特征的描述。該濃度-響應關系可以使用4/5參數的logistic函數(4/5PL 模型)來描述。圖1. A.5參數logistic (5PL)加權非線性最小二乘法回歸擬合的曲線。平均響應是表IV.中列出了第6個運行(batch)的重復結果。B.圖1A中回算標準點濃度的百分比相對誤差。所有數值都在標稱值的10%以內。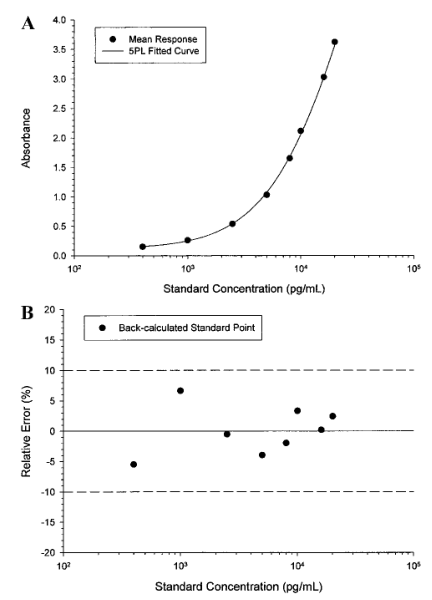
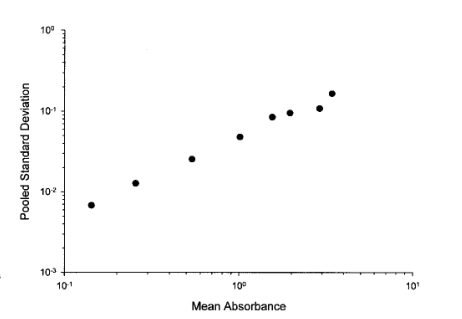
擬合曲線時,對平均響應值是否加權的問題,應通過對復孔數值的標準方差與不同濃度點的平均值之間的關系來評估決定。例如,表IV中標準校準點濃度的混合標準方差與平均響應的關系圖在對數刻度上顯示了一個線性增加的關系(圖2)。在這種情況下,加權擬合通常比不加權更合適。在考慮刪除復孔值的標準時,有關復孔值變異性的信息會非常有用。
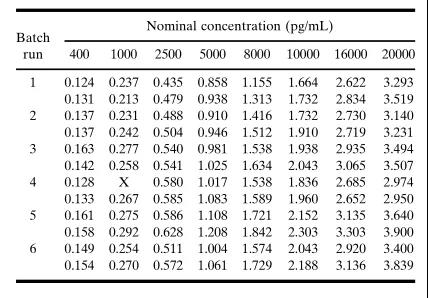
圖2. 表IV所列標準曲線吸光度值的混合運行(batch)內標準方差與累積平均響應之間的關系。每個點代表一個濃度點的平均值和通過方差分析(ANOVA)計算的標準方差。在高吸光度水平下,變異性較大;這表明,在擬合標準曲線時,加權可能是適當的。
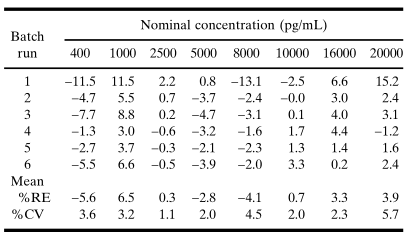
在建立校準模型時,建議分析至少3個獨立運行(batch/run)的標準曲線濃度-響應數據,每次運行應包含兩條標準曲線,以便評估運行內標準曲線的可重復性。模型的適宜性取決于標準點回算濃度的RE,計算一個濃度點的RE如下:從回算濃度中減去標稱濃度并將其差值除以標稱濃度。通常,對于曲線內的大多數標準點回算濃度的絕對RE應為20%。例如,根據加權5PL回歸曲線擬合平均光吸收值(表IV中第6個運行的數據)所得出的模型,回算濃度的絕對REs都是<10%(表V和圖1B)。同樣,其他5個運行的絕對REs也始終一致地<10%(第1個運行中的幾個點除外)。
表 V. 對于表IV中數據的平均響應,回算的標準濃度的百分比相對誤差 (%RE)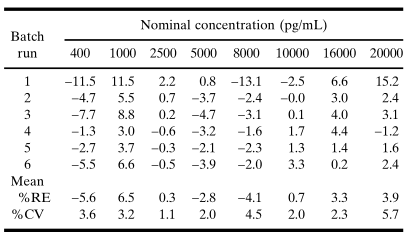
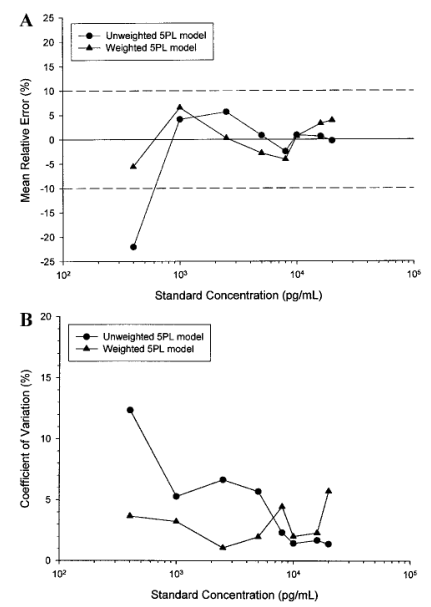
一個可被接受的校準模型,其曲線的累積回算數值對于在預期的定量范圍內的所有濃度,應具有10%的絕對平均RE值和15%的變異系數(CV)(參見表V)。在校準品濃度范圍中,如果平均RE存在一個趨勢,即回算濃度始終一致地高于或低于標稱濃度,則是擬合失敗的證據,會使該模型失效。擬合失敗可能是由于選擇了不合適的平均值函數(例如,在濃度-響應曲線不對稱時使用了4PL函數)或加權過程不當。例如,加權使得擬合的曲線與表IV中的數據更相符,其證據是:在較低濃度部分,降低了平均RE(圖3A)和CV(圖3B);而在較高濃度部分,準確性或精密度的損失極小。圖3. A.未加權和加權五參數logistic(5PL)回歸曲線回算濃度的累積平均相對誤差百分比的比較與表IV的吸光度數據相吻合。加權模型的結果在整個標準濃度范圍是可以接受的,而非加權模型在低于1000pg/mL濃度是不可接受的。B.未加權和加權五參數logistic (5PL)回歸曲線回算濃度變化的累積百分比系數的比較與表IV的吸光度數據相吻合。加權回歸模型的計算值總結如下在表V中。加權模型在較低濃度水平下得到了較小的批間變化系數。
表IV.一個研究前驗證的標準曲線響應值
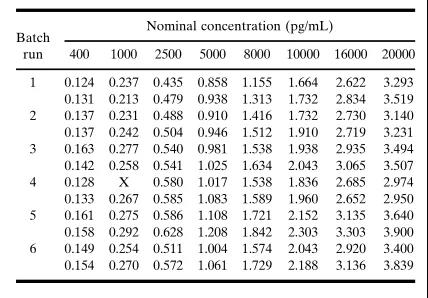
表 V. 對于表IV中數據的平均響應,回算的標準濃度的百分比相對誤差 (%RE)
研究前驗證階段
對研究前驗證所需的標準校準品,應根據方法開發過程中獲得的性能信息來制備。通常,對于使用4/5PL函數來擬合的濃度-響應關系,在預期的濃度范圍內,應至少包括6個非零、復孔校準點,這些校準點應在對數刻度上近似均勻地間隔。為了改善曲線擬合,可以包括定量范圍之外的錨定點或校準點。
在方法開發過程中建立的回歸模型應在至少6個獨立的研究前驗證運行中得到確認,通常也在相同的運行中評估方法的精密度和準確度。在一個運行中接受標準曲線時,回算濃度值(至少為75%,不包括錨定點和校準點)的%RE應在標稱濃度的20% 以內(對于LLOQ,%RE應在25%以內)。驗證結束時,應為每個校準點計算所有運行的累計平均%RE和%CV,如果每一個標準點(不包括錨定點)的RE和CV均為15%,則回歸模型是可以接受的;在LLOQ,%RE和%CV應為20%。應當在報告驗證樣品的分析結果之前確認回歸模型。由于可確定的原因造成了技術誤差(如,移液誤差),或可通過應用a priori統計標準編輯標準曲線,屏蔽某些校準點。
研究中驗證階段
對每個研究中的測試運行,應使用與研究前驗證相同的標準,監測標準曲線和編輯標準曲線中某個校準點。標準曲線的編輯必須獨立于QC,并于評估QC樣品的性能之前完成。編輯后剩余的校準點的最終數量必須≥總校準點的75%;或者除錨定點外,至少有6個校準點。如果刪除高(ULOQ)或低校準點(LLOQ)中的任何一個,這個運行的定量范圍將被限制在下一個校準點,所以,必須重新分析超出定量范圍的樣本。本文如有疏漏和誤讀相關指南和數據的地方,請讀者評論和指正。所有引用的原始信息和資料均來自已經發表學術期刊、官方網絡報道等公開渠道, 不涉及任何保密信息。參考文獻的選擇考慮到多樣化但也不可能完備,歡迎讀者提供有價值的文獻及其評估。










































