

























在競爭日益激烈的制藥行業,按照法規、指南等傳統模式進行生物分析,已經無法適應不斷增長的資源、時間、生產效率和加速決策的需求。通過一個分級驗證適合其用途的PK LBA方法的方式,可以在生物藥開發的早期階段做出科學合理的決策,從而提高新藥開發的效率。
本文將著重介紹并描述PK LBA方法中校準曲線的設計、生成、編輯以及擬合模型和權重選擇的相關思考和建議。由于篇幅有限,本文將采用上下篇的形式來展開論述,敬請垂注!
1.導論
校準曲線(Calibration curve)代表了檢測到的響應變量與標準參照(比)物(reference standard)濃度之間的關系,這個關系假定了該標準參照物能夠代表真實測試樣本中的目標分析物(analyte of interest)或待測物。
校準曲線用于通過插值計算定量地測定樣本中未知濃度的待測物。校準曲線的產生,是通過將待測物加入被判斷為能真實地代表樣本的基質中而形成校準品,隨后依照未知樣本和質量控制樣品(QC)的儀器讀出值,然后根據校準(或標準)曲線進行內插從而計算未知樣本的濃度。
為了優化擬合非線性校準曲線,應當考慮三個因素:
(1)擬合平均濃度與響應的關系;
(2)對非線性劑量-響應曲線中的已知差異率(heteroscedasticity/non-constant response-error relationship,非恒定的響應-誤差關系)使用適當的權重;
(3)使用適當的曲線擬合算法來估算擬合的參數。
對樣本定量的準確度取決于該分析方法的校準曲線的穩健性和可重復性,該分析方法反過來又取決于參照(比)物(reference material)和其他測試組分(assay component)的性能。應該在方法開發階段中徹底評估配體結合式測試(LBA)方法的組成成分(即試劑)的性能特性,這些包括但不限于固體或固定的表面(如96孔板)和捕獲/檢測抗體。同時,應當制定適當的計劃,以監控批次間相關試劑的一致性。
此外,相關法規指導文件和該領域專家發表的指導性文件中定義了設計校準曲線的一般要求、校準樣品的驗收標準以及如何選擇適當的回歸模型。遵守這些已發布的準則和要求可提高校準曲線的可重復性(跨運行和跨研究)。
總之,每個生物分析實驗室都有責任在其標準操作程序(SOPs)中定義LBA校準曲線的設計、產生、驗收和編輯標準。本文旨在為產生校準曲線以及處理校準品數據點提供建議和最佳做法。雖然本文的內容也可能適用于某些生物標志物的檢測方法,但其重點仍然是用于定量藥代動力學(PK)的LBAs的校準曲線。其他所有的測試類型或格式都暫不討論。
LBAs和色譜分析方法的校準曲線之間存在著關鍵區別。在LBAs中,儀器響應可能與待測物的濃度呈正比關系(directly),也可能與待測物濃度呈反比關系(inversely),這取決于該分析方法是非競爭性還是競爭式的。無論采用何種格式,可以使用半對數坐標系(semi-log scale)將曲線轉換成響應與待測物濃度之間的S型關系。這與色譜分析方法不同,在色譜分析中,儀器響應通常是濃度的線性函數,兩者在大多數校準曲線范圍內是呈成正比例關系的。對于色譜法來說,線性關系的喪失表明該方法已經達到了它的檢測極限。
LBAs方法依賴于待測物與結合試劑(如抗體或受體部分)的相互作用,而這與傳統的色譜分析不同,在傳統的色譜分析中,待測物的檢測不依賴于其與某個大分子的結合(binding)。蛋白質-蛋白質相互作用的動態平衡性質導致了LBAs的非線性響應。此外,由于LBAs的效能在很大程度上取決于其所使用的生物試劑的性能,因此其檢測結果往往表現出較大的變異性(variance)。
非線性的LBA校準曲線限制了曲線上端和下端的濃度-響應的相關性,使得曲線處于平臺狀態,因此形成S型曲線。在典型的sigmoidal校準曲線中,下部平臺(漸近線asymptote)及其附近代表了背景響應,上部平臺代表接近最大響應。通常認為4PL模型是擬合此形狀校準曲線的首選。另外,在校準曲線的漸近線(上、下平臺部分)上進行定量將導致產生較差的精密度和準確度。這些特性最終縮小了LBA方法的有效定量范圍,使得選擇合適的非線性數據擬合算法變得更加重要。
有多種商業軟件可用來執行LBAs的非線性回歸。大多數分析儀器制造商均有提供與設備兼容的非線性回歸軟件。實驗室可選擇安裝獨立軟件或使用其實驗室信息管理系統(LIMS)來進行回歸擬合,具體取決于哪種軟件更能滿足其需要和要求。
用于擬合LBA校準曲線的軟件應該具有使用4個和5個參數logistic模型(Four and five parameter logistic regression,4和5 PL)進行回歸分析的能力,并且能夠:
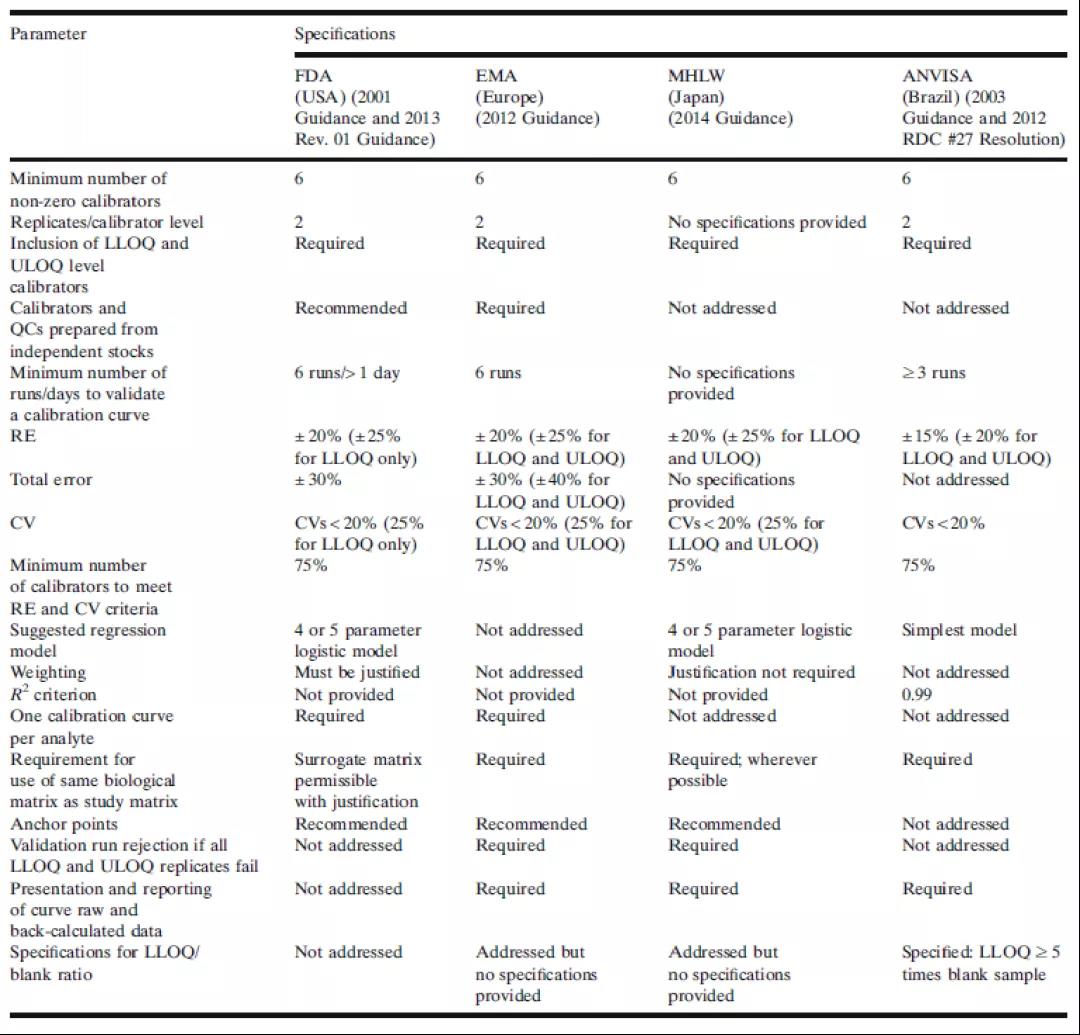
當前,一些生物分析指南或法規文件的生物分析部分已經對校準標準曲線的最低要求進行了確定。這些指導性文件對LBA曲線的需求和性能預期通常是相互一致的。表1總結了來自美國食品和藥物管理局(FDA)、歐洲藥品管理局(EMA)、日本衛生、勞動和福利部(MHLW)和巴西衛生監管機構(ANVISA)對校準曲線的要求。FDA和EMA指南是絕大多數生物分析實驗室遵從的主要指南。各個制藥廠商應根據各自計劃所提交的新藥審核監管機構來決定自身需要遵從的指南法規。
校準標準品(Calibrator standards)是通過將已知濃度的參照(比)藥物加入到與研究樣本基質相同或一致的,經過認證的基質(matrix)中而產生的。這些校準標準品的濃度——響應關系則確定了該測試方法的校準曲線。在涉及多種藥物聯合使用的研究中,研究樣本中的每個待測物都需要一條校準曲線。校準標準品的制備必須獨立于質量控制樣品(QCs),以避免潛在的藥物加入造成誤差的擴散或放大。
這意味著校準標準品和QCs可能不能使用相同中間庫存的藥物參照(比)品來制備,但可以通過連續稀釋藥物參照(比)品的初級或中級庫存來制備校準標準品。制備校準標準品不需要在每個濃度水平上單獨外加藥物參照(比)品來制備,盡管這種做法意味著需在更高一級的水平上對校準曲線的質量控制,并可以監測外加藥物參照(比)品的精確度。無論藥物參照(比)品的中間庫存組成如何,校準標準品應包含至少95%的研究樣本基質。
使用LBAs方法的期望是在可能的情況下,盡一切努力在生物基質中制備校準標準品,該生物基質在物種、組成成份和基質預處理等方面必須與研究樣本的基質相匹配。例如,若研究樣本是未經過濾的血清,那么制備校準標準品的基質也必須是來自相同物種的未經過濾的血清。需要注意的是,研究人群通常是伴有相關的疾病,而校準品基質(calibrator matrix)則是來自于健康的受試者。如果沒有其他對待測物做定量分析的方法,那么用替代基質來制備校準品也是合理的,例如當研究使用的基質稀缺或很難獲得時,當研究藥物有內源性同源物時,在對生物標志物進行檢測時等。
當使用替代基質來制備校準品時,該生物分析方法應該使用研究樣本基質制備的QCs和研究基質選擇性樣本(study matrix selectivity sample)進行驗證,并與替代基質中制備的校準曲線進行比較和評估。除此之外,還建議分析者進行其他試驗,以證明替代基質與研究基質的稀釋曲線兩者之間的可比性。一種普遍接受的方法是測試上下漸近線、增長率(growth rate)以及5PL曲線中不對稱因子的等同性。當前業界內已提出如何測試平行性(parallelism)的方法,平行性測試是一個評估LBA方法相對準確性的基本實驗。通過分析稀釋對基質中內源性待測物定量的影響,可以在單個實驗中評估該測試方法的選擇性、基質效應、所需的最小稀釋率、健康和患病人群的內源性待測物的水平以及LLOQ。
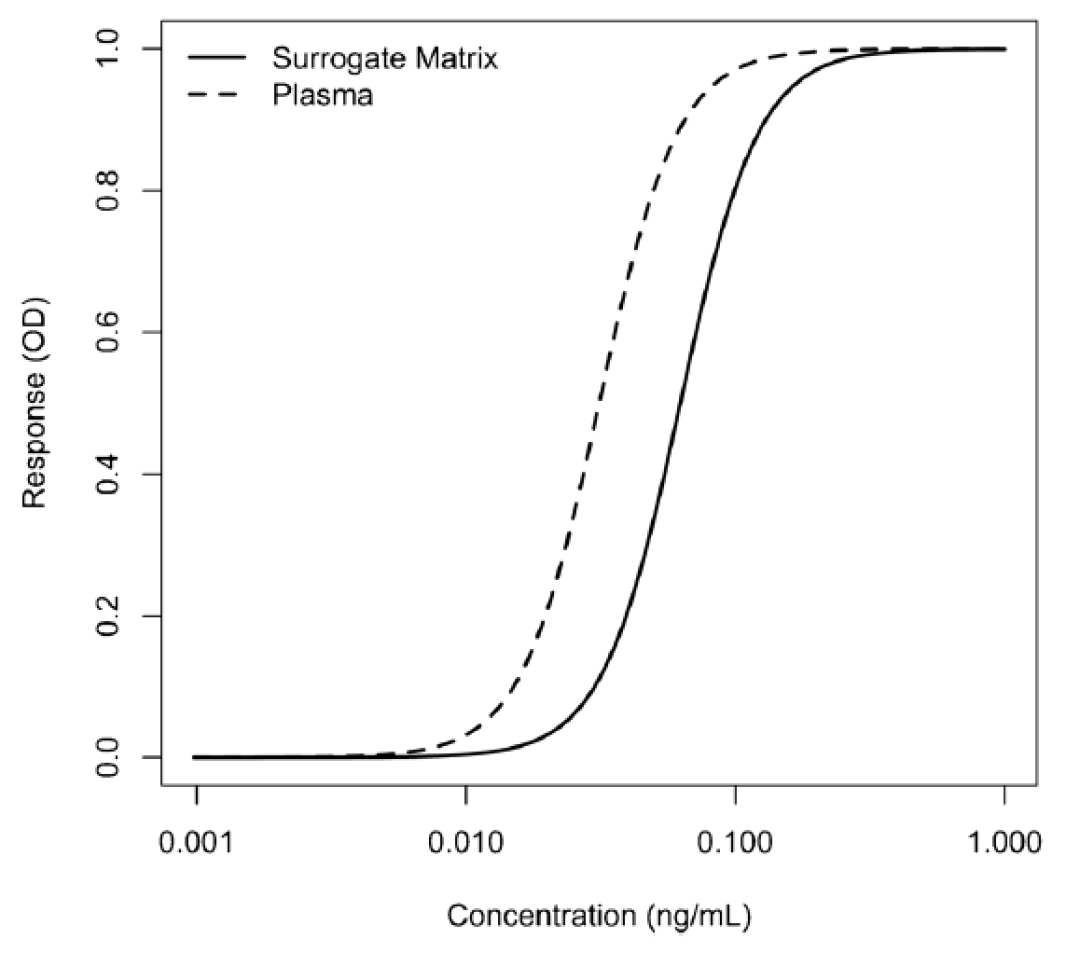
這些等效性測試的接受標準尚未確定,但已在業界廣泛討論。圖1提供了在人血漿中制備的校準曲線的示例,同時也提供了在緩沖液(替代基質)中制備的校準曲線。它們是兩條平行的曲線。
校準樣品可用100%或以最低稀釋度(minimum required dilution,MRD)稀釋后的基質配制。使用MRD稀釋基質的方法的例子包括但不限于罕見基質或在自動化平臺上執行的方法,在這些平臺上使用100%基質可能會由于有限的可及性(limited availability)或由于基質的粘度而成為問題。在方法開發過程中,應根據測試方法性能來決定校準樣品是用100%的基質還是用MRD稀釋的基質制備,應根據具體的實際情況進行適當的評估,以確保校準樣品和QC的回收率在理論值的預期范圍內(例如,±20%)。當在100%基質中制備時,校準樣品需要以用于QCs和研究樣本相同的MRD來稀釋。未知樣品回算的濃度應報告為100%基質中的濃度。
在生物分析應用中,選擇認證后的混合基質(qualified matrix pool,QMP)的過程至關重要。建議認證和儲存足夠的混合基質,確保足以用來完成方法開發、驗證和至少第一次研究中樣本分析。還建議將QMP儲存在與QCs和研究樣本相同的條件下。例如,如果樣本的儲存溫度小于或等于-65℃,則QMP也應儲存在該溫度范圍內。
在方法開發過程中,可以篩查、選擇和合并單個基質樣本或單個混合基質來生成QMP,商業來源的混合基質也可能適用。QMP篩查應包括評估對未外加和外加了待測物的基質樣品的檢測信號。例如,出于篩查的目的,可以在單個基質樣本加入相當于LLOQ水平的待測物。具有高背景或加標回收率不合格的基質樣品應排除在QMP之外。基質樣品的驗收標準的一個實例可以是:使用QMP制備的校準曲線,至少有80%的所有單個基質樣品的加標回收率在理論濃度的80%至120%之間。QMP應該能代表研究人群,通過混合滿足接受標準的個體基質樣本來制備。
LBA校準樣品可以是新鮮制備的或者冷凍的。不少實驗室在所有階段習慣使用新制備的校準樣品,包括方法開發、研究前驗證和隨后的生物分析。新鮮的校準樣品可以從原始或中間參考標準的庫存(original or intermediate reference standard stock)中調取。如果使用中間參考標準,必須在發布驗證報告之前確定其穩定性。在研究前的方法驗證中,使用新制備的校準樣品來評估冷凍的QCs,可以初步建立QCs的穩定性。
一旦初步確立了QC的穩定性,實驗室就可以利用這些信息來制備和儲/凍存單個校準樣品。如果將LLOQ和ULOQ樣品包含在穩定性測試中,且穩定性測試窗口覆蓋了校準樣品的存儲期,則此方法就是可以接受的。預先認證和凍存校準樣品的目的是減少測試運行之間的變異性和提高操作效率。凍存的校準樣品應分裝在足夠一次性使用的容器中,并應避免校準樣品的反復融凍。
監管機構為校準曲線的設計提供了指南。以下是指南準則的簡短總結:
ULOQ和LLOQ分別代表定量分析范圍的上限和下限,必須作為研究前驗證的一部分進行驗證。為了驗證LLOQ和ULOQ校準樣品,僅僅在這些級別上包括校準樣品是不夠的,還需要在LLOQ和ULOQ水平上制備驗證樣品(QCs),這些QCs必須包括在研究前驗證的準確度和精密度的評估中。ULOQ校準樣品必須分別滿足相對誤差(RE)為±20%和變異系數(CV)為≤20%的接受標準;LLOQ校準樣品則必須分別滿足FDA指南中規定的±25%的RE和≤25%的CV,才能被納入校準曲線。一旦經過驗證,LLOQ和ULOQ水平校準樣品將成為校準曲線的一個組成部分,并且必須包括在每次測試運行中。
研究中每個待測物在每次分析測試運行應當有一條校準曲線,校準范圍必須適合并符合研究樣品中待測物的預期濃度范圍。一般來說,寬大的定量范圍有助于一次性地定量分析含有大范圍待測物濃度的大量樣本。狹窄的定量范圍則限制了該測試方法的分析能力,導致不必要的重復分析,即需要額外稀釋從而使樣本濃度進入校準曲線范圍。雖然將待測物濃度為零的校準樣品定義為不含待測物的基質樣品不是必須的,但可能是有益的。
目前的建議是對LBA校準樣品進行重復(duplicate)分析,盡管變化趨勢如高CVs,可能需要進行三次(triplicate)復測。只有在該方法的量化范圍內證明了原始響應的穩健性和高精密度的情況下,才能認為使用單次測量(單孔singlicate)是合理的。
2012年EMA生物分析指南中討論了非線性回歸擬合時錨定點的作用,并在整個行業中推薦使用錨定點。錨定點被定義為在測試方法的定量范圍之上和之下的校準樣品,但它們不受與校準曲線點相同的性能要求的約束。錨定點的價值和在回歸分析時使用錨定點并不是被普遍接受的,但是建議將它們作為方法開發過程的一部分,并評估它們對改善整體回歸分析的作用。
使用錨定點是否能改善曲線擬合,應基于所提出的數學算法或加權因子,并應在個案基礎上確定。錨定點可能特別有助于增強曲線擬合,不僅在過度寬大或狹窄的校準曲線的情況下,而且在使用加權因子的校準模型中也是如此。在某些情況下,位于LLOQ以下的錨定點增強了曲線的擬合,并有助于LLOQ滿足其接受標準。
目前監管機構尚未就校準樣品之間的間距和ULOQ/LLOQ信號比作出明文指導。一般推薦使用相等的校準樣品的間距,如采用對數刻度(例如,on a logarithmic scale of the power of 2),這有利于改善測試方法的性能。
校準樣品濃度的選擇部分是基于以下的實際考慮:即在進行多個測試運行時,易于制備和無差錯地復制校準品濃度。建議分析者使用系列稀釋(serial dilution)的方法,并使用一個固定的稀釋比例(使用與被分析的實際樣本相同的基質稀釋校準品)。最終結果是,校準品在濃度范圍的對數刻度上的間隔大致均勻/相等的。在這些條件下,Rocke和Jones確定了校準品的最佳稀釋比例,該比例通常為2:1或3:1。2:1的系列稀釋與6個校準品濃度將產生一系列如1X,2X,4X,8X,16X,32X(稀釋倍比為2n: n = 0,1,2,3,4,5的曲線)。對于典型的響應遞減曲線(D<A),Rocke和Jones的研究也顯示,如果使用最佳間距,校準品濃度曲線的中點應略高于預期的IC50濃度(當LBA用于活性測定時)。這意味著在曲線較小方差(variance)的區域有更多的校準點。對于上述2:1的稀釋比例,應調整X,以便所預期的IC50 濃度位于8X稀釋的校準濃度點附近。可以添加額外的校準樣品(如果已包括在回歸模型的評估中)來更好地定義校準曲線的拐點(inflection point)。
在LLOQ附近加入更緊密相鄰的校準樣品可能有助于在LLOQ失效時,將靈敏度的損失降到最低。在校準曲線中包含零濃度的校準樣品不是監管機構的要求或標準做法,然而,如果一個實驗室選擇將零作為校準曲線擬合的一部分,則建議在LLOQ和零校準樣品之間留有足夠的間距,以保護LLOQ不會失敗。例如,2012年的EMA指南規定LLOQ的信號至少是空白樣本信號的5倍。每個實驗室應根據測試方法的效能(performance)為其確定適當的間距。
ULOQ/LLOQ濃度比受測試格式(format)、平臺(platform)和試劑特性的影響。實驗室的目標應該是最大限度地提高ULOQ/LLOQ濃度比,并可設定其最低目標,如10/1。
選擇一個合適的非線性回歸模型需要經過多次迭代才能獲得LBA校準曲線的最佳擬合。目前的監管指南是建議使用能夠獲得足夠擬合度的最簡單模型來進行擬合,建議在評估任何可能的權重之前,首先選擇回歸模型。評估權重能否減輕不同濃度下測試響應不等同的變異性也很重要。
此外,還需要考慮的一個關鍵參數是可報告的測試結果的質量,對它的考慮應該超越對模型擬合質量的考慮,并且可以通過準確度進行評估。因為準確度概要(Accuracy profile)有助于各種擬合模型的可視化。必須強調的是,目前的研究文獻不鼓勵如下操作:(1)使用線性函數來近似S形曲線;(2)對數據進行對數-對數轉換(log-log transformation)來使得固有的非線性關系近似于線性。
校準曲線常用的非線性模型是4PL和5PL,可以通過許多自動化軟件實現擬合。雖然可以使用其他的非線性模型,但須謹慎且應對4PL和5PL模型不適用的特殊情況加以證明。
4PL模型最常見的參數化形式是:
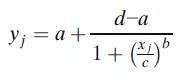
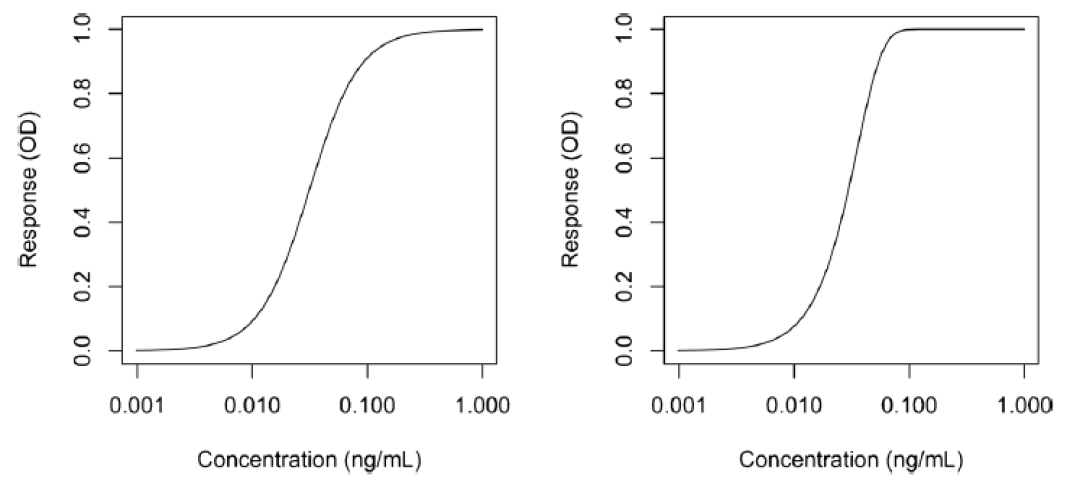
其中yj是對應濃度xj的響應,a為上漸近線,d為下漸近線,c為曲線拐點處的濃度,b為生長因子。該模型的一個特點是拐點附近的對稱性,而拐點對應于d和a之間距離的一半。這個模型雖然也可應用,但它通常產生的是一個不對稱的校準曲線,因而需要使用5PL模型擬合。
5PL模型的一般參數化形式是:
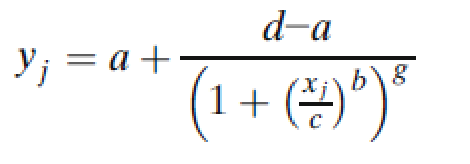
其中g是不對稱因子。當g=1時,5PL函數與4PL函數完全等價。圖2說明了4PL和5PL曲線之間的差異。
LBA校準曲線擬合的另一個常見挑戰是不同校準樣品濃度下響應的不相等變異性(unequal variability),即響應的噪聲(variance)通常不是恒定的,而是隨著響應而變化,這種現象被稱為異方差性(heteroscedasticity),可以通過對模型進行加權處理,使其與濃度范圍內響應的可變性成比例。如果應對異方差性得當,校準曲線擬合的質量則可以提高。應對的基本思想是在表現出較高變異的響應上減少其"權重"。換句話說,校準曲線與低變異數據更緊密地擬合,并允許稍微偏離較高變異的數據,以這種方式加權可得到更寬泛的定量范圍,并在該范圍內提高準確度和精密度。如果不使用適當的權重,將會導致LLOQ和ULOQ附近的插值有更大的偏差(bias)和不精密度(imprecision)。適當使用權重可以減少重復測試的響應值中的不相等方差(unequal variance)。
大多數軟件都具有執行加權回歸所需的功能。軟件通常會選擇常用的權重,如1/Y和1/Y2,并通過評估響應-誤差關系(response-error relation)來選擇最佳的權重函數。1/Y的權重增強了曲線底部的點,1/Y2的權重增強了曲線頂部和底部的點。還有其他權重因子和加權方法也同樣可以使用,并可能能夠更好地滿足特定測試方法的需求。
雖然曲線的非對稱性和異方差性(heteroscedasticity)是曲線擬合的重要考慮因素,但如果沒有適當的預評估,將它們包含在模型中可能會導致擬合一個過于復雜的模型。在校準曲線中包含反映測試方法自然變化的參數可能會導致回算誤差和增加所報告的結果的偏差(bias)。
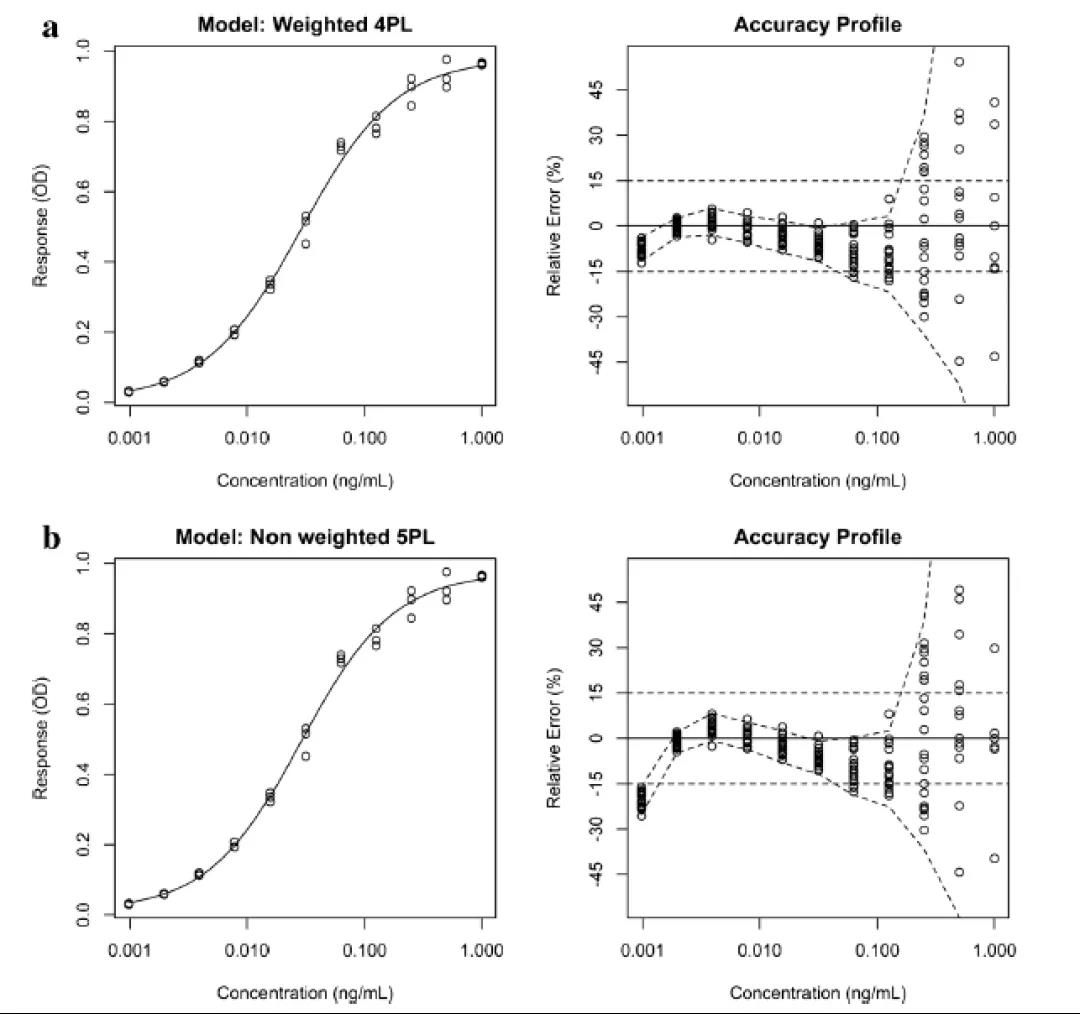
做回歸分析時,有許多不同的方法可用于統計評估模型擬合的質量。(包括R2和均方誤差(root mean square error)。但這些參數并非適用于所有情況,它們的設計目的是將響應的誤差最小化,而不是將所報告的結果的誤差最小化。此外,Anscombe’s quartet表明,高度不同的數據可以獲得相似的擬合質量,但并不能保證反向預測的相似。準確度曲線(accuracy profile)是一種基于未來可報告結果的替代性圖形方法,它將各濃度水平下測試所得的可報告結果與真實值之間相對差異的b-期望容差區間(b-expectation tolerance interval)聯系起來。
b-期望容差區間被定義為某個比例(b%)的未來結果預期會下降的區間。該工具可以方便地可視化偏差、精密度和定量限(limit of quantitation,LOQ/定量限,在這里準確度超出了可接受的范圍),提供了一種可以用來比較多個模型的簡單方法,并方便從中選擇精度最高的可報告結果的模型。
圖4給出了兩條不同的校準曲線及其基于15%相對誤差的相關準確度曲線(RE,定義為實驗值和理論值之間的差值與理論值之比)的接受極限(acceptance limit)。15%相對誤差的接受極限是指南推薦的。
至少有75%的校準樣品,包括LLOQ和ULOQ校準樣品,按回算濃度,必須通過接受標準:即該回算濃度在理論濃度的±20%(低定量限為±25%)的范圍內,而CVs低于20%(在低定量限為<<>25%)(另見表1)。對于每個校準樣品,應該報告回算濃度的CVs,而不是儀器響應的CVs。首先,應該根據精密度排除校準樣品。每次排除后,應重新對曲線進行回歸分析和評價。其次,應該一次只排除一個校準樣品,并且按偏差大小的順序,從擁有最高偏差(RE)的校準樣品開始。另外,只有在需要時才排除其他校準樣品。
屏蔽(masking)被定義為:在標準曲線回歸時不使用某個校準點,而該校準點的數值仍存在于系統中。在討論曲線編輯時,屏蔽和排除(exclusion)這兩個術語可以互換使用。每個A校準點通常是在微孔板的兩個孔(復孔)中進行重復(duplicate)測試。如果曲線擬合是基于復孔測試的平均值,則只有當兩個孔的測試結果都滿足接受標準時,才能接受該校準點。在這種情況下,不建議排除一個孔的數值,而只使用另一個孔的結果。在某些試平臺,如Singulex,每個校準點可能測試三次,在這種情況下,三個孔中至少有兩個必須通過,才能接受該校準點。
如果LLOQ和ULOQ校準點的所有重復測試都失敗,那么該驗證運行就失敗了,應該調查失敗的可能原因(EMA 2012)。編輯校準曲線只能在可以確定失敗原因的情況下進行,例如:記錄在案的外加藥物誤差,或移液器誤差,或使用了先驗的統計標準。校準曲線的編輯必須獨立于QC的評估, 這意味著,不能排除校準點以方便QC的通過,除非不符合與校準樣品相關的接受標準。每個實驗室必須在其標準操作程序中定義如何屏蔽和編輯校準點。
屏蔽和排除校準樣品的一般準則如下:
一旦測試運行通過,每個樣本都可以根據校準曲線進行評估。如果一個未知樣本結果的CV%可接受,并且平均濃度落在該方法的定量范圍內,則該結果可以被報告。如果樣本的平均濃度超出了定量范圍,則應在適當的稀釋后重新測試該樣本,以獲得在定量范圍內的結果。如果一個測試結果在定量范圍內,而另一個復測結果低于LLOQ或高于ULOQ,則應該報告平均值,前提是平均值在經過驗證的定量范圍內,且CV%是可接受的。樣本濃度結果應報告為100%的基質,在考慮了測試方法的MRD和任何其它稀釋的倍數之后。
正如在前一節中提到的,如果LLOQ校準點失敗且必須被屏蔽,定量范圍就截斷到下一個最低的校準點。在這種情況下,LQC仍必須由可接受的校準樣品包含在內(bracketed),否則檢測失敗。如果是ULOQ失敗,曲線的上端向下移動到下一個可接受的校準點,且必須包含在可接受的校準樣品內,否則檢測也同樣失敗。如果樣本的測定值低于LLOQ或高于ULOQ,則必須調整樣本的稀釋倍數,再重新分析該樣品,使其測定值落在定量范圍內。
LBA校準曲線可能容易隨時間發生校準漂移。校準曲線性能的漂移定義為由于參比標準品、分析試劑和其他測試組分的反應性或結合特性的變化而導致的校準偏移。這種變化可能會改變校準曲線的斜率或其他性質,最終導致樣本的濃度報告為過高或過低。同時,該方法的定量上限和下限,或樣本的稀釋線性,也可能發生變化。
可能導致校準曲線性能漂移的因素包括但不限于:(a)新批次的混合基質;(b)關鍵試劑特性(如純度、特異性和捕獲或檢測抗體的結合親和力)的變化;(c)含有蛋白質或脂質添加劑或載體的非關鍵試劑的性能變化;以及(d)對參比標準品配方的修改。應在方法開發的早期就開始監測校準曲線的性能,并在研究前驗證和樣本分析階段繼續進行。此外,在多個臨床研究的時間跨度上,跟蹤校準漂移是至關重要的。但是,目前還沒有用于監測校準曲線性能的共識或已經建立的方法。
監測校準曲線漂移的建議包括:
旨在確定藥物濃度以支持藥代動力學研究的,高質量和可靠的配體結合測試方法(LBA)在生物藥的開發過程中起著至關重要的作用。在典型的LBA方法中,使用校準曲線通過內插值(interpolate)測定質量控制樣品和未知樣品中的藥物濃度。對大多數LBA方法,預計測試信號與藥物濃度的關系是非線性的。因此,建議應用多參數,通常為4或5參數Logistic regression (4PL或5PL)的數學方法,在定量范圍內,擬合至少6個校準樣品的數據點以獲得校準曲線。可考慮使用其他校準樣品(包括零點或其他錨定點)來提高曲線擬合的質量。
應根據對準確度曲線(accuracy profile)的分析,選擇最適當和最簡單的回歸模型(可能應用加權因子,weighting factor)的相關回歸分析的軟件,作為實驗室信息管理系統的一部分,或作為儀器數據分析包的一部分,或作為獨立軟件包都可以提供這樣的數據分析。校準曲線的質量以及最終測試結果的質量高度地依賴于校準樣品的制備過程、所使用的樣本基質的類型以及校準樣品的儲存條件。FDA、EMA、MHLW和ANVISA發布的機構指南在不同程度上討論了校準曲線參數及其性能要求,其中許多要求是相互一致的,但也存在一些差異。
本文旨在描述進行回歸模型選擇、校準曲線設計和數據分析的方法,主要目的是幫助讀者開發高質量的生物藥定量分析方法,以支持非臨床和臨床藥代動力學研究。文中花了較大的筆墨詳細討論的一個重要內容是與編輯校準曲線的規范和適當規則有關。同時提供了對于編輯校準曲線的建議,這些建議遵循科學上健全,同時也符合行業慣例的原則。當然,其他方法也可以,如果其科學性和適用性被證明是可以接受的。
本文如有疏漏和誤讀相關指南和數據的地方,請讀者評論和指正。所有引用的原始信息和資料均來自已經發表學術期刊、官方網絡報道等公開渠道, 不涉及任何保密信息。參考文獻的選擇考慮到多樣化但也不可能完備。歡迎讀者提供有價值的文獻及其評估。
19.U.S. Food and Drug Administration, Title 21 of the U.S. Code of Federal Regulations: 21 CFR 11 “Electronic Records; Electronic Signatures”, Aug 2003.https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfCFR/CFRSearch.cfm.

