

























今日(12月20日),國家衛健委辦公廳發布了《新型抗腫瘤藥物臨床應用指導原則(2019年版)》(下稱《原則》),該《原則》由“新型抗腫瘤藥物臨床應用指導原則”和“各系統腫瘤的藥物臨床應用指導原則”兩部分組成,其中“各系統腫瘤的藥物臨床應用指導原則”共涉及8類臨床藥物。

新型抗腫瘤藥物臨床應用指導原則
(2019年版)



現代抗腫瘤藥物的一個顯著特征,是出現一批針對分子異常特征的藥物——即靶向藥物。最具代表性的藥物是針對表皮生長因子信號通路異常的酪氨酸激酶抑制劑。目前,根據是否需要做靶點檢測,可以將常用的小分子靶向藥物和大分子單克隆抗體類藥物分為兩大類(表1)。具體的檢測靶點詳見各章節。
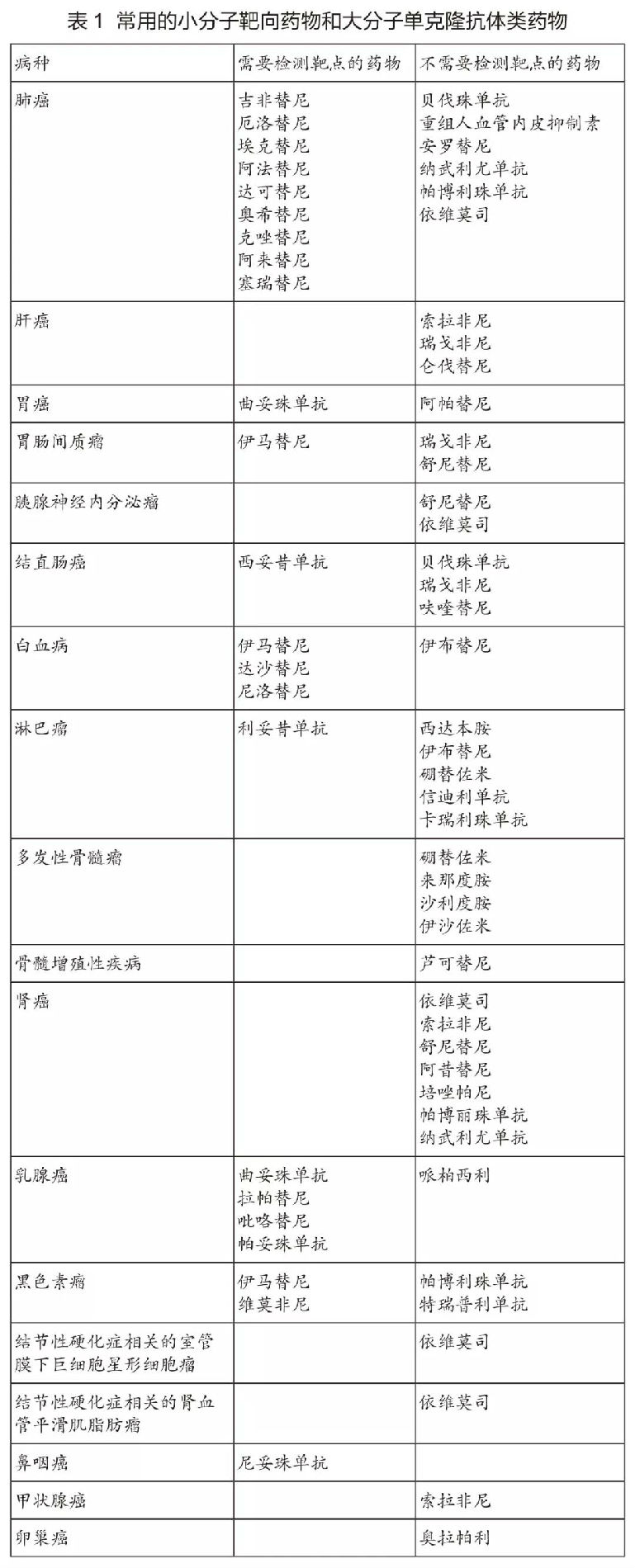
對于有明確靶點的藥物,須遵循靶點檢測后方可使用的原則。檢測所用的儀器設備、診斷試劑和檢測方法應當經過國家藥品監督管理部門批準,特別是經過伴隨診斷驗證的方法。不得在未做相關檢查的情況下盲目用藥。

