

























本期《袁來如此》為系列文章《大分子生物分析概論》的第七篇,將重點(diǎn)就已發(fā)表的文獻(xiàn)資料對(duì)抗體的總濃度和游離濃度的定量分析及其在藥代動(dòng)力學(xué)中的應(yīng)用進(jìn)行初步的介紹。
由于內(nèi)容篇幅較長(zhǎng),本文將采取上下篇形式進(jìn)行推送,敬請(qǐng)垂注!《袁來如此》專欄系廣州博濟(jì)醫(yī)藥微信公眾號(hào)打造的科普學(xué)術(shù)專欄,內(nèi)容均為博濟(jì)醫(yī)藥子公司深圳博瑞副總經(jīng)理袁智博士原創(chuàng)。
支持用于藥物開發(fā)的生物分析的主要驅(qū)動(dòng)力是數(shù)據(jù)的預(yù)期應(yīng)用。配體結(jié)合式測(cè)試方法(LBA)被廣泛用于蛋白質(zhì)生物藥和靶標(biāo)配體(target ligands,L)的分析,以支持藥代動(dòng)力學(xué)/藥效學(xué)(PK/PD)和安全性評(píng)估。特別是對(duì)于以非共價(jià)鍵結(jié)合其靶標(biāo)配體的單克隆抗體藥物(mAb),體內(nèi)可以存在多種形式的mAb與其靶標(biāo)配體,包括游離的mAb,游離的L以及mAb和L的一價(jià)和/或二價(jià)復(fù)合物(mono- and/or bivalent complexes of mAb and L)。
考慮到給藥后體內(nèi)發(fā)生的動(dòng)態(tài)結(jié)合平衡的復(fù)雜性以及在生物分析過程中該平衡受到多種來源的擾動(dòng),對(duì)待測(cè)物的不同形態(tài)(游離、結(jié)合或總體mAb和L)以間接體內(nèi)形式(ex vivo)進(jìn)行定量分析得出的結(jié)果,可能與體內(nèi)(in vivo)的實(shí)際情況不同。原則上,可以設(shè)計(jì)LBA試劑和測(cè)試格式,用于測(cè)定mAb和L的總濃度或游離濃度。
本文主要關(guān)注mAb生物藥與血液循環(huán)中以可溶形式分泌出來的,或從膜受體上脫落的靶標(biāo)配體和L。本文從理論和實(shí)踐上研究了如何測(cè)定的總體/游離的待測(cè)物濃度,以提升科學(xué)界的相關(guān)認(rèn)知,并提供了相關(guān)生物分析策略,以便在藥物開發(fā)的特定階段提供所需的PK/PD的信息。
基于靶向藥理機(jī)制的生物藥已經(jīng)成為了當(dāng)前頗具前景的藥物開發(fā)方式。生物藥主要由單克隆抗體(mAb)藥物組成,很多個(gè)mAb已經(jīng)FDA批準(zhǔn)作為藥物上市使用,預(yù)計(jì)未來將有更多相關(guān)藥物獲得進(jìn)入市場(chǎng)。
定量測(cè)定血液循環(huán)中的mAb及其靶標(biāo)配體(L)的可靠分析方法對(duì)于評(píng)估m(xù)Ab的暴露量-響應(yīng)關(guān)系、支持其有效性和安全性評(píng)價(jià)、治療劑量的選擇是至關(guān)重要的。配體結(jié)合測(cè)定法(LBA)通常用于定量分析mAb及其相關(guān)L的濃度,在生物體內(nèi)環(huán)境中存在多種形式的mAb和L,包括游離mAb、游離L和 mAb和L的一價(jià)和/或二價(jià)復(fù)合物。當(dāng)L是二聚體或多聚體時(shí),則會(huì)產(chǎn)生額外的復(fù)雜性,可以設(shè)計(jì)LBA試劑和分析格式來進(jìn)行測(cè)量,包括mAb及其L的結(jié)合及游離形態(tài)。這其中,確定LBA方法所測(cè)量的確切形態(tài)至關(guān)重要。
由于LBA的數(shù)據(jù)是用于評(píng)估藥代動(dòng)力學(xué)/藥效學(xué)(PK/PD)關(guān)系,因此,為了適當(dāng)評(píng)估PK/PD,使用相關(guān)的分析方法清楚地闡明mAb和L的相互作用是非常重要的。本文描述如下相關(guān)共識(shí)
同時(shí),本文為選擇mAb和L的總體和游離濃度的測(cè)定方法提供了一個(gè)實(shí)用的策略,將從以下方面闡述:
生物體液中游離、部分游離(partially free,也稱為部分結(jié)合/ partially bound),結(jié)合(bound)全部(total)mAb和L的術(shù)語。對(duì)于mAb,將其“游離/free”部分實(shí)用性地定義為表現(xiàn)出與其未結(jié)合形式(unbound forms)相等同的生物活性的形式。由于mAbs的二價(jià)性,游離mAb既包括未結(jié)合(unbound)mAb,也包括部分結(jié)合mAbs(即一價(jià)結(jié)合的/monovalently bound),這些形式通常是使用未結(jié)合的參考標(biāo)準(zhǔn)物(unbound reference standards)來定量的。總體mAb將是完全結(jié)合形式(fully bound)、部分結(jié)合形式(partially bound)和非結(jié)合形式(unbound)的總和。
除了與mAb結(jié)合外,L還可以與其它蛋白質(zhì)結(jié)合,并且L上可能有多個(gè)結(jié)合位點(diǎn),具有或不具有協(xié)同效應(yīng)。為了簡(jiǎn)化討論,本文將不討論L的多價(jià)結(jié)合(multivalent binding)和與近端蛋白(proximal protein)結(jié)合。在此,本文簡(jiǎn)化了靶標(biāo)配體,L,的定量,只包括“游離”(非結(jié)合,Lfree)和總體(包括與mAb結(jié)合和非結(jié)合的形式,Ltotal);相應(yīng)的參考標(biāo)準(zhǔn)物由特定的方法來確定。
雖然本文提供了一些文獻(xiàn)中的案例研究和例子,但目的不是要包羅萬象。為了避免文章冗長(zhǎng),不會(huì)詳細(xì)討論表1中的例子,只作為參考文獻(xiàn)列出。有興趣的讀者可參閱相關(guān)文獻(xiàn)。
生物分析戰(zhàn)略的主要驅(qū)動(dòng)力是使用這些數(shù)據(jù)為藥物開發(fā)進(jìn)行決策參考。取決于決策所需要的信息,在藥物開發(fā)的不同階段所需的數(shù)據(jù)以及因此所選擇的定量方法(游離,全部,或兩者都要)可能不同。
在藥物開發(fā)的早期階段,特定的試劑可能無法用于開發(fā)游離的mAb或L的分析方法。因此,生物分析科學(xué)家和數(shù)據(jù)使用者應(yīng)了解并就下列問題進(jìn)行交流:
(1)生物分析數(shù)據(jù)的預(yù)期用途;
(2)血液循環(huán)中mAb和L之間的動(dòng)態(tài)平衡關(guān)系;
(3)分析方法的技術(shù)性挑戰(zhàn)(technical challenges)及其實(shí)際局限性(practical limitations)。

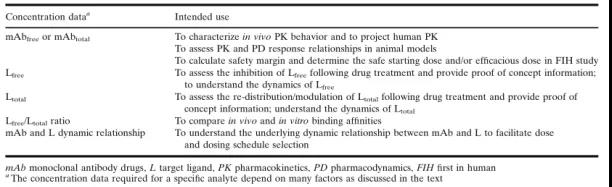
在臨床前開發(fā)階段, 血清mAb的濃度用于建立非臨床物種中的PK行為,并預(yù)測(cè)首次人體給藥(FIH)時(shí)的起始劑量 (表2)。靶標(biāo)配體L的濃度用于評(píng)估m(xù)Ab與L的動(dòng)態(tài)平衡關(guān)系,以幫助確定具有生物活性的mAb濃度,并用于PK建模,從而確定給藥劑量和方案。
臨床階段的數(shù)據(jù)則用于描述人體藥代動(dòng)力學(xué)特征,定義PK/PD與安全性和有效性的關(guān)系,并在目標(biāo)患者人群中建立PK/PD模型,以支持藥物的批準(zhǔn)上市和使用以及藥品標(biāo)簽。詳細(xì)的PK/PD數(shù)據(jù)的應(yīng)用列于表2和表3。
在許多情況下,生物藥的藥理效應(yīng)是由游離的mAb和mAbfree所決定的。如果mAb與可溶性配體結(jié)合,以防止其與同源受體結(jié)合(或通過其傳遞信號(hào))。如果能夠在游離靶標(biāo)配體與Lfree的結(jié)合與臨床響應(yīng)之間建立起相關(guān)性,與L的結(jié)合和捕獲就可以作為PK/PD建模和給藥方案選擇時(shí)一個(gè)直接的生物標(biāo)志物。雖然 mAbfree反映了mAb在體內(nèi)的游離狀態(tài)和結(jié)合能力,但評(píng)估m(xù)Abtotal可以進(jìn)一步幫助描述mAb與L之間的動(dòng)態(tài)相互作用。mAb/L的比值與其動(dòng)態(tài)平衡(dynamic equilibrium)高度影響生物分析方法的特異性。因此,了解藥物開發(fā)不同階段所需的信息是十分重要。

藥代動(dòng)力學(xué)家通常對(duì)mAbfree頗為敏感,因?yàn)閙Abfree的水平反映了可利用的活性藥物。當(dāng)然,毒理學(xué)家也對(duì)mAbtotal非常敏感,因?yàn)閙Ab的靶向或脫靶效應(yīng)(on- or off-target effects)可能帶來安全隱患。因此,在使用這些數(shù)據(jù)之前,藥代動(dòng)力學(xué)家和毒理學(xué)家必須了解具體的生物分析方法是什么,并決定是否需要進(jìn)行額外的分析。
就此而言,如果在藥物開發(fā)的后期改變了定量分析方法,那么可能需要重新評(píng)估PK或PD模型,因?yàn)檫@些模型是基于特定的定量分析方法產(chǎn)生藥物濃度-時(shí)間行為。從游離或結(jié)合的mAb的分析方法的角度,有綜述分析了21個(gè)FDA已批準(zhǔn)上市的mAb藥物的LBA方法。這些報(bào)告大多沒有具體說明分析方法的格式,因此不同分析方法產(chǎn)生的PK參數(shù)可能不一致。
由此來看,在制定mAb的生物分析策略時(shí),重要的是與不同功能團(tuán)隊(duì)中的關(guān)鍵利益攸關(guān)方合作。包括藥物開發(fā)項(xiàng)目所處的階段,何時(shí)以及如何測(cè)定每個(gè)藥物開發(fā)項(xiàng)目中的mAb和L。
質(zhì)量作用定律支配著mAb和L的結(jié)合。
該定律首先是由Guldberg和Waage于1864年提出,并被廣泛用于描述可逆性結(jié)合的相互作用(reversible binding interactions):從steroid hormones與其結(jié)合蛋白,到mAb和L的可逆性結(jié)合。一般選擇對(duì)靶標(biāo)配體(L)的有高結(jié)合親和力(binding affinity)的mAb作為藥物來開發(fā),平衡解離常數(shù)(equilibrium dissociation constants,Kd)通常在幾個(gè)nM到pM的濃度范圍。結(jié)合動(dòng)力學(xué)一般是非線性的、容量有限的(capacity limited),其結(jié)合符合二級(jí)動(dòng)力學(xué)特征(second-order association)。
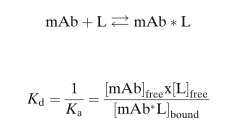
其中,Kd和Ka分別為平衡解離常數(shù)和結(jié)合常數(shù)。
質(zhì)量作用定律可用于計(jì)算或預(yù)測(cè)平衡中各組分的濃度。Le Chatelier原理也描述了平衡隨濃度變化而移動(dòng)的趨勢(shì)。圖1表明,mAb結(jié)合到L的部分(fraction of mAb bound to L),除取決于Kd外,還取決于mAb和L的濃度比值。
圖1. 在一定的mAb/L摩爾比范圍內(nèi),mAb-L親和力對(duì) mAbfree的影響。將L的濃度固定為常數(shù),用于模擬計(jì)算 mAbfree。為了便于解釋,本例中的摩爾比是基于假設(shè)每摩爾藥物有一個(gè)結(jié)合位點(diǎn);對(duì)于mAb,每摩爾藥物有兩個(gè)結(jié)合位點(diǎn)。
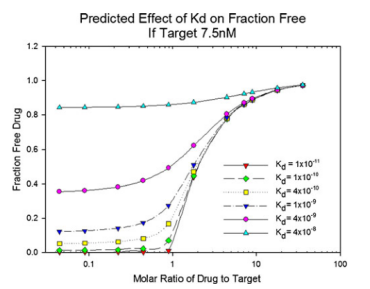
圖1. 在一定的mAb/L摩爾比范圍內(nèi),mAb-L親和力對(duì) mAbfree的影響。將L的濃度固定為常數(shù),用于模擬計(jì)算 mAbfree。為了便于解釋,本例中的摩爾比是基于假設(shè)每摩爾藥物有一個(gè)結(jié)合位點(diǎn);對(duì)于mAb,每摩爾藥物有兩個(gè)結(jié)合位點(diǎn)。
在給藥后,一般假定mAb與可溶性L的結(jié)合遵循質(zhì)量作用定律。因此,可以定量分析血漿或血清樣本中mAb和L的濃度,以闡明PK/PD關(guān)系的動(dòng)態(tài)平衡。如在《藥物和靶點(diǎn)生物分析數(shù)據(jù)的應(yīng)用》章節(jié)中所討論的,根據(jù)質(zhì)量作用定律的預(yù)測(cè),mAb或L的體內(nèi)平衡將以依賴于PK動(dòng)力學(xué)和L的響應(yīng)動(dòng)力學(xué)的方式,向游離或結(jié)合狀態(tài)移動(dòng),如表4所示的情況分類。高比例的mAb/L的第一種情況是高劑量的mAb與L具有高結(jié)合親和性,這是藥物開發(fā)中經(jīng)常遇到的情況。 但在某些情況下,L可能會(huì)累積并在某些時(shí)間點(diǎn)導(dǎo)致mAb/L比值降低。Lfree和/或Ltotal的增加可能在給藥后伴隨L的積累而發(fā)生,并可能抵消抑制L的預(yù)期效果,或可能帶來其他安全問題。
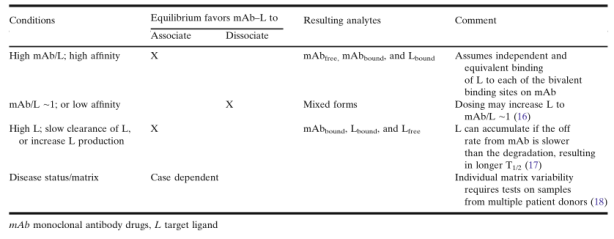
除了考慮給藥后mAb-L結(jié)合的體內(nèi)動(dòng)力學(xué)外,離體狀況(ex vivo conditions)如樣品采集、儲(chǔ)存、運(yùn)輸和樣本分析等可能使樣本的平衡狀態(tài)與體內(nèi)(in vivo)狀態(tài)大不相同。表5列出了一些可能影響結(jié)合或解離平衡動(dòng)力學(xué)的狀況。
在樣品采集和分析過程中,由于平衡可能受到擾動(dòng),不同mAb和/或L的相關(guān)形式(游離的、結(jié)合的、總L和mAb)的離體定量可能會(huì)偏離體內(nèi)的實(shí)際值。此外,偏差的程度取決于研究過程中樣本采集的時(shí)間,因此,很難預(yù)測(cè)由這樣的實(shí)驗(yàn)確定的PK/PD行為與體內(nèi)的真實(shí)狀況的相似程度。

在含有這些不同形式的混合物的樣本中,而且當(dāng)很難控制mAb和/或L的特定形式的平衡動(dòng)力學(xué)時(shí),將平衡驅(qū)動(dòng)到主要以mAb和L的游離或結(jié)合(總體)的形式存在,然后進(jìn)行定量分析的價(jià)值較大。此外,使用分離步驟來分離游離的和結(jié)合的形式,并定量特定的形式,以獲得藥物開發(fā)的每個(gè)階段所需的PK或PD信息。許多LBA檢測(cè)平臺(tái)和條件都足夠靈活,可以完成這項(xiàng)工作。
本文后續(xù)將分別在《抗體藥物的定量生物分析方法》和《靶標(biāo)配體的生物分析方法》章節(jié)中,討論針對(duì)mAb和L的具體形式的多種定量方法。敬請(qǐng)垂注!


